Что такое диабетическая полинейропатия нижних конечностей. Сенсомоторная нейропатия
новые данные о лечении Актовегином uMEDp
Сахарный диабет является наиболее распространенным эндокринным заболеванием; по данным статистических исследований, им страдают около 4% населения. В России число лиц с нарушением углеводного обмена приближается к 10 миллионам человек. Наряду со столь высокой распространенностью сахарный диабет является и одной из основных причин ранней инвалидизации и смертности больных трудоспособного возраста. Данная категория пациентов имеет высокий риск ампутации нижних конечностей при хронической инфицированной язве или гангрене стопы, возникающей на фоне периферической сенсомоторной невропатии и/или патологии магистрального кровотока нижних конечностей (1, 2).
Рисунок 1. Профили средней оценки по шкале TSS в группах терапии
Рисунок 2. Профили среднего порога вибрационной чувствительности в течение периода терапии
Диабетическая невропатия – это клиническое или субклиническое поражение нервной системы, развивающееся на фоне сахарного диабета при отсутствии других причин невропатии. Наибольшее клиническое значение среди всех диабетических невропатий имеет дистальная сенсорная или сенсомоторная нейропатия (ДСН), составляющая 80% клинических случаев.
По данным нового широкомасштабного популяционного обследования, проведенного среди жителей Аугсбурга (Германия) распространенность ДСН в Европе составляет 28% среди лиц больных сахарным диабетом, 13% – с нарушением толерантности к глюкозе, 11,3% – с нарушением гликемии натощак и 7,4% – с нормальной толерантностью к глюкозе (5). Основными факторами риска и прогрессирования нейропатии являются: неудовлетворительная компенсация сахарного диабета, висцеральное ожирение, длительность заболевания и рост. Также определенное значение оказывают артериальная гипертензия, возраст, курение, гипергликемия и дислипидемия (6).
Дистальная сенсомоторная невропатия приводит к повышению порогов «защитной» чувствительности нижних конечностей, что сопровождается высокой подверженностью тканей стопы травмам и развитию безболевых язв стоп и диабетической нейроостеоартропатии (стопы Шарко). Повышение порога вибрационной чувствительности является предиктором образования нейропатических язв стоп – наиболее частой причины госпитализации и ампутации нижних конечностей у больных сахарным диабетом (7).
Боль, связанная с диабетической нейропатией, нарушает сон, сопровождается депрессией и снижает качество жизни. Хроническая нейропатическая боль постоянно беспокоит 16-26% больных сахарным диабетом (8, 9). По данным российского исследования EPIC, невропатические боли при диабетической полиневропатии выявлены у 10% обследованных лиц и по распространенности уступают только болям в спине. Несмотря на этот факт, только 65% пациентов получают лечение в Великобритании, хотя 95% жаловались на боль своим врачам (8). Терапия боли включала антидепрессанты в 43% случаев, противосудорожные препараты в 17,4% случаев, опиоидные аналгетики в 39% и альтернативные препараты в 30% случаев.
В последние 5 лет наши знания в области патогенеза и ведения диабетической нейропатии значительно продвинулись. В настоящее время убедительно показано, что кроме неудовлетворительного контроля глюкозы традиционные сердечно-сосудистые факторы риска являются независимыми факторами риска диабетической и периферической нейропатии. Напротив, факторы риска развития болевой диабетической полинейропатии остаются неизвестными, хотя в исследовании когорты EURODIAB обнаружено, что женский пол может быть независимым фактором риска. Патогенез болевой формы нейропатии также неясен. Получены данные, демонстрирующие различия в эпиневральном кровотоке, микроциркуляции кожи стопы, интраэпидермальной плотности нервных волокон и результатах магнитно-резонансной спектроскопии таламических структур между лицами, страдающими болевой и безболевой формами диабетической нейропатии (3).
Примерно 1% пожилых людей в европейских странах имеют риск развития язвы стопы как проявление осложнения сахарного диабета. Когда к нейропатии присоединяется артериальная недостаточность, риск прогрессирования язвы в гангрену и ампутацию десятикратно увеличивается.
Диабетические язвы стоп при отсутствии заживления в течение длительного времени оказывают негативное влияние на качество жизни, увеличивают риск инфекции и ампутации. Больные сахарным диабетом, сопровождающимся язвенными дефектами стоп, требуют большего внимания и затрат.
Уровень заживления язв варьирует от 24 до 82% после 12 недель лечения. Стандартная помощь состоит из очищения язвы, контроля инфекции, разгрузки стопы и использования повязок, позволяющих осуществлять «влажное заживление» раны. Ответ на лечение в течение первых 4 недель лечения предопределяет прогноз. Если положительная динамика отсутствует в течение 4 недель, то применяется «продвинутое лечение», включающее применение цитокинов, биоэквивалентов кожи, терапию отрицательным давлением (4). Прямая стоимость лечения нейропатических язв стоп до момента заживления составляет около 5000 евро по данным Норвежского исследования (23). При этом стоимость амбулаторного лечения составила 29%, ортопедического обеспечения –28%, госпитализации – 20%, местного лечения – 11%, антибиотиков – 11% и домашнего ухода – 4%. Кроме высокой стоимости отмечается значительная длительность лечения, до момента заживления составляющая 19 (4, 61) недель.
Таким образом, диабетическая периферическая нейропатия является распространенным поздним осложнением сахарного диабета, приводит к развитию как болевой, так и безболевой невропатии с развитием хронических невропатических язв стоп. Данные осложнения значительно снижают качество жизни, сопровождаются высокими затратами на лечение в случае развития невропатической болевой формы невропатии или диабетической стопы и требуют необходимости оказания дорогостоящей междисциплинарной помощи, включая расходы на хирургию, реабилитацию и социальную поддержку в случае развития ограничений жизнедеятельности. Именно поэтому наилучшими перспективами является профилактика, включающая раннее выявление факторов риска, обучение и осуществление комплекса превентивных мероприятий, в том числе применение препаратов, модифицирующих факторы риска.
Лечение нейропатии
Прогрессирование ДСН во многом зависит от тяжести диабета и степени поддержания гликемического контроля во времени (10). В лечении боли применяют различные нелекарственные методы лечения (акупунктура, магнитотерапия, чрескожная электронейростимуляция, массаж и др.), эффективность которых остается недоказанной (11). В настоящее время в лечении нейропатической боли наиболее эффективной является лекарственная терапия. Следует сразу подчеркнуть, что простые анальгетики и нестероидные противовоспалительные препараты в лечении болей при ДСН не рекомендуются из-за их неэффективности и высокой частоты нежелательных явлений при длительном применении (осложнения со стороны ЖКТ, печени и крови). Основными группами препаратов для лечения нейропатической боли при ДСН являются: антидепрессанты, антиконвульсанты, опиоидные анальгетики.
В настоящее время обсуждаетcя возможность патогенетического лечения болевой невропатии.
Роль актовегина в лечении полинейропатии
Актовегин обладает широким спектром действия, оказывая преимущественное влияние на метаболизм клеток, ускоряя захват и потребление глюкозы. Кроме того, Актовегин активирует окислительный метаболизм, смещая баланс в сторону окисленных субстратов, что сопровождается повышением доступности макроэргических фосфатов, таких как АТФ и креатинфосфокиназа.
Исследования на животных показали, что Актовегин является универсальным антигипоксантом, влияя на дыхание митохондрий, повышая выделение кислорода. В различных экспериментах, проводимых на крысах, подтверждено, что Актовегин оказывает защитный эффект при гипоксическом повреждении клеток, что объясняется усилением захвата глюкозы клетками. Причем воздействие Актовегина универсально регистрируется в печени, сердце, головном мозге. Актовегин способен повышать концентрацию АТФ в различных тканях (12,13). Существуют прямые и косвенные доказательства в пользу инсулиноподобного эффекта Актовегина, который опосредуется влиянием фосфоинозитол-сахаридов, являющихся компонентами препарата, на транспорт глюкозы в клетку. Этот эффект осуществляется независимо от действия инсулина (14).
Клинические исследования Актовегина показали его протективный эффект в отношении диабетической невропатии, так как снижение кровотока в эндоневрии и ишемия нерва играют важную роль, наряду с метаболическими нарушениями, вызванными гипергликемией, в патогенезе этого осложнения (15, 16). В современных исследованиях in vivo с использованием свежеприготовленных нейронов крыс показано, что Актовегин повышает длину аксонов и количество синаптических связей нейрона, а также ингибирует апоптоз, путем влияния на активность каспазы-3, основного фермента, способствующего апоптозу (данные в процессе публикации).
В проведенном ранее плацебо-контролируемом клиническом исследовании, включавшем 70 пациентов с диабетической полинейропатией, показано, что Актовегин улучшал скорость нервной проводимости, аллодинию и субъективное самочувствие через 24 недели терапии (17).
Учитывая длительный опыт работы с Актовегином в России, было проведено обсуждение и предложено проведение первого в мире мультицентрового слепого плацебо-контролируемого исследования по лечению симптоматической полинейропатии Актовегином больных сахарным диабетом типа 2, результаты которого опубликованы в журнале Diabetes Care (18). В исследовании принимали участие 26 исследовательских центров России, Украины и Казахстана под координацией Institute for Clinical Diabetology, German Diabetes Center, Leibniz Institute at the Heinrich Heine University, Düsseldorf, Germany (professor D. Ziegler). Исследование было направлено на оценку эффективности и безопасности терапии Актовегином в дозе 2000 мг/сут. внутривенно однократно в количестве 20 инфузий с последующим назначением препарата внутрь (1800 мг/сут.) в течение 140 дней. В качестве первичных критериев эффективности использовали шкалу общих симптомов (TSS, Total Symptom Score) для нижних конечностей и порог вибрационной чувствительности (VPT – Vibration Perception Threshold), рассчитанные как площадь под кривой (AUC, Area Under the Curve). Вторичные конечные точки включали отдельные симптомы шкалы TSS (стреляющая боль, жгучая боль, парестезия и онемение), оценку по комбинированной шкале нейропатических повреждений для нижних конечностей (NISS-LL, Neuropathy Impairment Score of the Lower Limb) и шкалу качества жизни (SF-36). При терапии Актовегином в сравнении с плацебо отмечалось значительное улучшение по шкале TSS спустя 160 дней по сравнению с исходной точкой (-0,86 балла, р
Таким образом, терапия Актовегином в виде внутривенных инфузий с последующим переходом на прием внутрь через 160 дней улучшала симптомы нейропатии, порог вибрационной чувствительности, сенсорную функцию и качество жизни у пациентов с сахарным диабетом 2 типа и клиническими проявлениями диабетической полинейропатии (18).
Отмечена эффективность лечения больных сахарным диабетом и нейроишемическим болевым синдромом при периферических ангиопатиях: уменьшение болевого синдрома в ногах, увеличение прогулочного расстояния, улучшение скорости проведения возбуждения по нервам (19). В результате проведенного открытого сравнительного исследования продемонстрировано, что последовательное лечение Актовегином в виде инфузий в дозе 2000 мг в сутки 1 раз в день с переходом на поддерживающий прием Актовегина в таблетках в дозе 1200 мг в сутки в 3 приема в течение 6 недель (всего 8 недель лечения) достоверно увеличивает функциональную способность к ходьбе у больных сахарным диабетом и перемежающей хромотой. При этом достоверно увеличивается время до появления болевых ощущений (PWT, peak walking time) при использовании теста ходьбы на тредмиле (протокол Gardner) и утомляемости в конечностях уже через 2 недели от начала лечения после окончания инфузионного курса и продолжает нарастать после 6 недель курса таблетированного лечения (22). При этом отмечено достоверное улучшение состояния периферических нервов (по шкале NDS, Neuropathy Disability Score).
Проведение пилотных открытых исследований в хирургических клиниках при включении Актовегина в комплекс лечения больных с синдромом диабетической стопы (хронические язвы, гнойно-некротические процессы) позволяют предположить возможность стимуляции процесса заживления язвенных дефектов при лечении Актовегином, что вполне объяснимо с точки зрения патофизиологического воздействия препарата (20, 21).
umedp.ru
СПОСОБ ВЫЯВЛЕНИЯ УРОВНЯ ПОРАЖЕНИЯ ПЕРИФЕРИЧЕСКОЙ НЕРВНОЙ СИСТЕМЫ ПРИ СЕНСОМОТОРНОЙ НЕЙРОПАТИИ
Изобретение относится к области медицины, в частности к неврологии, и может быть использовано для уточнения уровня поражения периферической нервной системы при сенсомоторной нейропатии, а именно имеются ли изменения в структуре нервов и какой уровень и характер они носят: диффузный пролонгированный, сегментарный; симметричный или асимметричный.
Выбор наиболее рациональных методов диагностики больных с повреждениями и заболеваниями периферических нервов верхних и нижних конечностей в настоящее время представляет сложную проблему. Имеющиеся в наличии способы инструментальных методов диагностики в частности электронейромиография (ЭНМГ), магнитно-резонансную томографию (МРТ), либо не дают полную картину изображения нервного ствола, либо являются трудоемкими и дорогостоящими и требуют наличия сложного оборудования (Bodner G., Harpf С, Gardetto A., et al. Ultrasonography of the accessory nerve: normal and pathologic findings in cadavers and patients with iatrogenic accessory nerve palsy., J Ultrasound Med, 2002; 21: 1159-1163).
Нами было проведено комплексное исследование поражения периферической нервной системы при сенсомоторной нейропатии. Заболевание относится к группе периферических полинейропатий. Проводимые и представленные в настоящее время в отечественной и зарубежной литературе исследования уровня поражения периферической нервной системы при сенсомоторной нейропатии с помощью ультразвукового исследования, как правило, носят ограниченный характер, в виде локального исследования 1-2 нервов (Beekman R., Visser L.H. High-resolution sonography of the peripheral nervous system - a review of the literature. Eur J Neurol, 2004, 11: 305-314; Zaidman С.М., Al-Lozi M., Pestronk A. Peripheral nerve size in normals and patients with polyneuropathy: an ultrasound study. Muscle Nerve, 2009 Dec; 40(6):960-6).
Известен способ выявления уровня поражения периферической нервной системы при сенсомоторной нейропатии путем электронейромиографического (ЭНМГ) исследования состояния периферических нервов (Гурьева И.В. и др. Диабетическая периферическая сенсомоторная нейропатия. Патогенез, клиника и диагностика. Методические рекомендации, М., 2000,-21 с.). Однако данный метод исследования периферических нервов выявляет лишь степень выраженности нарушения проводимости импульсов по нервному стволу и не дает полную информацию об их состоянии, то есть не определяет уровень и характер его повреждения во всех случаях исследования.
Известно также использование ультразвукового сканирования периферических нервов, которое, по мнению ряда авторов (Салтыкова В.Г. Ультразвуковая диагностика состояния периферических нервов (норма, повреждения, заболевания). Автореферат диссертации на соискание ученой степени доктора медицинских наук, Москва, 2011), может достаточно успешно применяться при диагностике повреждений и заболеваний периферических нервов. Но в данном источнике отсутствуют сведения о комплексном ультразвуковом исследовании нервов верхних и нижних конечностей на всем их протяжении, что не позволяет выявить характер и уровень поражения при сенсомоторных нейропатиях. Несмотря на имеющиеся публикации по данной проблеме, следует признать, что вопросы ультразвуковой диагностики состояния периферических нервов остаются малоизученными. Вместе с тем постоянное совершенствование аппаратуры, высокочастотных датчиков и технологий ультразвуковых исследований расширяют возможности ее применения, а в ряде клинических ситуаций позволяют полностью заменить магнитно-резонансное исследование или существенно дополнить морфологическую, электронейромиографическую картину состояния мягкотканных структур той или иной области исследования. Данный источник информации принят нами за ближайший аналог.
Технический результат разработанного нами комплексного способа выявления уровня поражения периферической нервной системы при сенсомоторной нейропатии заключается в том, что ультразвуковое исследования нервов верхних и нижних конечностей на всем их протяжении обеспечивает высокую степень выявления характера и уровня поражения, уменьшает время диагностического поиска поражения, что в дальнейшем позволяет своевременно разработать тактику ведения больного и осуществлять наблюдение за ним во время лечения, до и после него без применения дорогостоящих и не всегда доступных методов лучевой диагностики.
Комплексное ультразвуковое исследование позволяет сформировать общую картину уровня поражения, его характер (диффузность или сегментарность) в случае выраженности двигательного дефицита и у постели больного при необходимости с краткосрочным проведением мониторинга.
Технический результат достигается тем, что для оценки характера поражения периферической нервной системы при сенсомоторных нейропатиях, проводят ультразвуковое исследование структуры нервов верхних и нижних конечностей, причем исследование структуры нервов конечности осуществляют на всем их протяжении и при нарушении кабельности строения на всем протяжении и снижении их эхогенности характер поражения оценивают как диффузный пролонгированный, при нарушении кабельности строения нервов на уровне сегмента конечности и снижении их эхогенности характер поражения оценивают как сегментарный, при нарушении кабельности строения в симметрично расположенных одноименных нервах верхних или нижних конечностей и снижении их эхогенности характер поражения оценивают как симметричный, при нарушении кабельности строения одного из симметричных нервов верхних или нижних конечностей и снижении в них эхогенности характер поражения оценивают как ассиметричный.
Способ осуществляется следующим образом.
Больному при поступлении с жалобами на боли, онемение, жжение, покалывание, отсутствие или нарушение чувствительности и снижение или отсутствие рефлексов в верхних и нижних конечностях проводят стимуляционное и игольчатое электронейромиографическое исследование состояния периферических нервов верхних и нижних конечностей. Методика проведения стимуляционной и игольчатой ЭНМГ описана в книге Одинак М.М. и др. Заболевания и травмы периферической нервной системы (обобщение клинического и экспериментального опыта). Руководство для врачей, Санкт-Петербург, изд. "СпецЛит", 2009. В случае наличия у больного нормальных показателей проводимости нерва или нарушения его проводимости при стимуляционной ЭНМГ и признаков реиннервации или денервации при игольчатой ЭНМГ ему назначают ультразвуковое исследование структуры нервов верхних и нижних конечностей на всем их протяжении. При этом для детального исследования нерва оптимизируют ультразвуковое изображение с использованием режима увеличения нерва, а также проводят качественный анализ структуры, контура, эхогенности нерва с последующим количественным расчетом толщины, передне-заднего размера и площади его окружности.
Для ультразвукового исследования применяют В-режим с использованием высокочастотных линейных датчиков от 9 до 17 МГц. Конвексные датчики с частотой 5 МГц используют при исследовании тучных пациентов для визуализации седалищного нерва на всем его протяжении до уровня бифуркации на большеберцовый и общий малоберцовый нервы. Ультразвуковую диагностику независимо от клинической картины начинают с исследования периферических стволов верхних конечностей, а затем нижних конечностей с использованием вначале поперечной области сканирования, а затем продольной по ходу анатомического строения нерва. В случае сегментарных структурных изменений нерва данную область исследуют еще и локально. В норме качественная оценка периферического нерва свидетельствует о кабельном его строении, обусловленное наличием множественных параллельных прерывающихся гипоэхогенных линий - соответствующих фасцикулам, и гиперэхогенных - соответвующих соединительно-тканным структурам - эпиневрию и периневрию. При этом эхогенность периферических нервов нижних конечностей выше.
Методика исследования периферических нервов осуществляется следующим образом.
Исследование срединного нерва, верхней конечности.
Пациент находится в положении лежа на спине или сидя с пронированной верхней конечностью. Исследование поперечного и продольного сканирования начинают в области запястья, на уровне карпального канала, продвигаясь в проксимальном направлении по ходу нерва до аксиллярной области (проксимальная часть плечевого сплетения). Получают изображение срединного нерва на всем протяжении верхней конечности по средней линии.
Исследование локтевого нерва.
Пациент находится в положении сидя с супинированной верхней конечностью. При этом кисти расположены на передней поверхности бедер. В процессе исследования расположение рук пациента должно быть свободным. Исследуемая рука не должна быть согнутой, поскольку при сгибании руки в локтевом суставе более 60 градусов диаметр нерва уменьшается за счет его уплощения.
Пациенты, находящиеся в положении лежа, располагаются на животе с вытянутыми вдоль тела руками, кисти ладонями обращены вверх.
Исследование поперечного и продольного сканирования начинают в области запястья, на уровне карпального канала, продвигаясь в проксимальном направлении по ходу нерва до аксиллярной области (проксимальная часть плечевого сплетения) по задней медиальной поверхности верхней конечности. Получают изображение локтевого нерва на всем протяжении верхней конечности по задней медиальной линии.
Исследование лучевого нерва.
Пациент находится в положении сидя или лежа с пронированной верхней конечностью, слегка согнутой в локтевом суставе. Исследование начинают со средней трети задне-латеральной поверхности плеча, продвигаясь в поперечной и продольной плоскости сканирования в дистальном направлении до уровня бифуркации на поверхностную и глубокую ветвь, а проксимально - продвигаясь до аксиллярной области - зоны формирования дистальной части плечевого сплетения. Для исследования плечевого сплетения используют 2 доступа: межлестничный и подмышечный. Для межлестничного доступа устанавливают датчик в поперечной плоскости сканирования и визуализируют вертикально расположенные стволы (верхний С5-6, средний С7 и нижний С8-Th2) сплетения между передней и средней межлестничными мышцами. А для подмышечного доступа располагают датчик в подмышечной ямке вдоль хода одноименной артерии при отведении или поднятии руки вверх. Получают изображение лучевого нерва на всем его протяжении.
При исследовании периферических нервов нижних конечностей пациент находится в положении лежа, на животе.
При исследовании пациентов в тяжелом состоянии и невозможности их перепозиции на живот проводят исследование в положении пациента на спине с согнутыми ногами в коленных суставах и несколько развернутыми в тазобедренных суставах. Для удобства ультразвуковой сканер располагают в ножном конце пациента.
Исследование седалищного нерва.
Для визуализации седалищного нерва устанавливают датчик в нижней трети задней поверхности бедра, продвигаясь в дистальном направлении в поперечной и продольной плоскости сканирования до уровня бифуркации на большеберцовый и общий малоберцовый нервы, а в проксимальном направлении - до уровня ягодичной складки. Получают изображение седалищного нерва на всем протяжении нижней конечности.
Исследование большеберцового нерва.
Для визуализации большеберцового нерва в поперечной и продольной области сканирования устанавливают датчик в подколенной области и в дистальном направлении продвигаются по задней медиальной поверхности голени к медиальной лодыжке. Получают изображение большеберцового нерва на всем его протяжении.
Исследование общего малоберцового нерва.
Для визуализации общего малоберцового нерва в поперечной и продольной плоскости сканирования устанавливают датчик в подколенной области и перемещают в дистальном направлении к наружному контуру голени. Глубокую ветвь визуализируют в дистальном отделе голени по передней большеберцовой кости. Поверхностную ветвь визуализируют по наружной поверхности голени. Получают изображение общего малоберцового нерва на всем его протяжении.
В результате проведенного исследования всех нервов периферической нервной системы при обнаружении нарушения кабельности строения нервов верхних и нижних конечностей на всем их протяжении и снижения эхогенности оценивают уровень поражения как диффузный пролонгированный. При обнаружении нарушения кабельности строения нервов в сегментах верхних или нижних конечностей и снижения эхогенности в них оценивают уровень и характер поражения как сегментарный. При обнаружении нарушения кабельности строения нервов в симметрично расположенных одноименных нервах верхних или нижних конечностей и снижения эхогенности в них оценивают уровень поражения как симметричный. А при обнаружении нарушения кабельности строения одного из симметричных нервов верхних или нижних конечностей и снижения эхогенности в нем оценивают уровень поражения как асимметричный.
Таким образом, своевременное получение объективной информации о структуре периферического ствола, уровне его поражения и протяженности, динамических изменений его в определенных временных интервалах: до и после оперативных вмешательств с учетом сопоставления с функциональными методами исследования проводимости нервных волокон является чрезвычайно важным, так как данная информация определяет тактику ведения пациента и контроль над его лечением.
Примеры реализации способа.
Пример 1.
Пациент Г., 23 года, поступил с жалобами на ограничение движения в верхней конечности и гипотрофию мышц верхнего плечевого пояса. Диагноз: сенсомоторная нейропатия нервов правой верхней конечности. Назначена стимуляционная и игольчатая ЭНМГ. При стимуляционной ЭНМГ ответы от нервов верхней правой конечности не регистрируются. При игольчатой ЭМНГ - денервация мышц, иннервируемых нервами верхней конечности. В этой связи больному проведено УЗИ нервов верхних и нижних конечностей на всем их протяжении. При этом отмечается: целостность дистального отдела плечевого сплетения справа и сегментарные изменения проксимальных отделов лучевого нерва за счет его утолщения и нарушения кабельности и расширения фасцикулярного компонента на уровне спиральной борозды плечевой кости; срединный нерв на уровне локтевого сгиба выявляется в виде булавовидного утолщения (с формированием невромоподобного образования). Уровень и характер поражения сегментарный ассиметричный, со снижением эхогенности в областях поражения, который учитывался в дальнейшем при разработке тактики лечения больного и его реабилитационных мероприятий. Это сократило сроки восстановления двигательного дефицита верхней конечности.
Пример 2.
Пациентка А., 44 года, в течение 2 лет жалобы на похудание правой голени. При поступлении поставлен диагноз сенсомоторная нейропатия нижней конечности. При исследовании вен: вены проходимы. Назначена стимуляционная и игольчатая ЭНМГ. При стимуляционном электронейромиографическом исследовании проводящая функция двигательного компонента нижней конечности и сенсорного большеберцового и малоберцовых нервов не нарушена. При игольчатой ЭНМГ - денервация мышц правой голени. Отсутствие выявленных нарушений проводимости по данным электронейромиографии при наличии клинических проявлений двигательного дефицита явилось показанием для проведения УЗИ нервов верхних и нижних конечностей, в результате которого выявлено следующее: слева на уровне нижней трети бедра веретенообразное опухолевое расширение нерва с переходом на общий малоберцовый нерв протяженностью до 10 см и толщиной до 12 мм с признаками васкуляризации: невринома. Эхогенность в областях поражения снижена. Уровень и характер поражения квалифицирован как сегментарный ассиметричный. В дальнейшем это учитывалось при разработке тактики лечения больного и его реабилитационных мероприятий, что сократило сроки восстановления нарушений в правой голени.
Пример 3.
Пациентка П., 59 лет, поступила с жалобами на боли в шее и в правом плече после проводниковой анестезии по поводу оперативного лечения перелома бугорка плечевой кости. Диагноз: сенсомоторная нейропатия правой верхней конечности. Больному проведена диагностическая магнитно-резонансная томография, по данным которого выявлена картина остеохондроза в плечевом суставе. Были также назначены стимуляционная и игольчатая электронейромиографии. По данным стимуляционной ЭНМГ выявлено, что проводящая функция нервов верхней конечности не нарушена. По данным исследования поздних ответов выявлены признаки дисфункции проксимальных отделов срединного нерва (25% выпадений F-ответов) и локтевого нерва (60% выпадений F-ответов). По данным игольчатой электронейромиографии в мышце, иннервируемой локтевым нервом - признаки выраженного денервационного процесса. При наличие указанных признаков на ЭНМГ для уточнения поражения периферических нервов верхних и нижних конечностей проведено ультразвуковое исследование. И, несмотря на наличие признаков дисфункции проксимальных отделов срединного нерва и локтевого нерва верхней конечности при электронеймиографическом исследовании, в результате УЗИ установлено, что в плане уровня поражения имеется целостность дистального отдела плечевого сплетения с признаками диффузных структурных изменений медиального и латерального пучков и наличия гематомы в межбугорковой борозде плечевой кости с наличием частичного повреждения сухожильно-мышечной порции двуглавой мышцы. Эхогенность в выявленных пораженных областях периферических нервов снижена. Таким образом, уровень и характер поражения квалифицирован как сегментарный, ассиметричный. Это учитывалось в дальнейшем при разработке тактики ведения больного, что позволило назначить более адекватное лечение и реабилитационные мероприятия.
Пример 4.
Пациентка Д., 62 года, поступила с жалобами на слабость в руках, ногах, онемение от уровня поясницы до пальцев ног, похудание ног на протяжении 12 лет. Диагноз: сенсомоторная нейропатия верхних и нижних конечностей. Больному назначены стимуляционное и игольчатое электронейромиографические исследования, в результате которых при стимуляционной ЭНМГ выявляются генерализованные поражения моторных волокон на всем протяжении верхних и нижних конечностей с признаками грубой демиелинизации и вторичной аксонопатией как диффузного, так и локального характера. На игольчатой ЭНМГ выявляется денервационный процесс в мышце, иннервируемой срединным нервом. В этой связи было проведено ультразвуковое исследование нервов верхних и нижних конечностей. В результате проведенного исследования выявлены асимметричные изменения локтевых и срединных нервов в проксимальных отделах и единичные фасцикуляции в мышцах кистей. Уровень и характер поражения квалифицирован как пролонгированный ассиметричный на фоне диффузного, который учитывался в дальнейшем при разработке тактики лечения больного и его реабилитационных мероприятий.
Пример 5.
Пациентка М., 51 год, считает себя больной с 2000 года, когда периодически отмечалось онемение в пальцах рук, тяжесть в ногах. В марте 2001 года присоединилось онемение в ногах, слабость и шаткость при ходьбе. Проходила стационарное лечение с диагнозом полинейропатия с дистальным нижним парапарезом. Больной назначены стимуляционная и игольчатая электронейромиографии. При этом на стимуляционной ЭНМГ выявлено снижение скорости проводимости всех периферических нервов. На игольчатой ЭНМГ выявлены денервационные и реиннервационные процессы в мышцах, иннервируемых срединным, локтевым, лучевым, седалищным, большеберцовым и общим малоберцовым нервами. В связи с этим было проведено ультразвуковое исследование нервов верхних и нижних конечностей. В результате исследования нервов верхних (срединного, локтевого, лучевого) и нижних конечностей (седалищного, большеберцового, общего малоберцового) выявлено симметричное диффузное генерализованное поражение нервов с выраженным их утолщением и нарушением кабельности строения на всем протяжении без динамических изменений во времени. Эхогенность пораженных нервов снижена. Уровень поражения оценивают как диффузный пролонгированный. Лечение и реабилитационные мероприятия проводились с учетом выявленных поражений периферических нервов.
Проведено исследование 287 больных с сенсомоторными нейропатиями различных уровней поражения периферической нервной системы (см. рис.1). Всем больным были проведены стимуляционная и игольчатая ЭНМГ с последующим ультразвуковым исследованием нервов верхних и нижних конечностей. Из них у 105 больных был выявлен уровень и характер поражения пролонгированный диффузный, у 45 больных - сегментарный, у 18 больных симметричный и у 119 больных - ассиметричный. Характер и уровень поражения периферических нервов выявлен с высокой степенью достоверности (р<0,05).
Следовательно, сочетание электронейрографического и ультразвукового исследования нервов верхних и нижних конечностей на всем их протяжении обеспечивает высокую степень выявления характера и уровня поражения, уменьшает время диагностического поиска поражения, что в дальнейшем позволяет своевременно разработать тактику ведения больного и осуществлять наблюдение за ним во время лечения, до и после него без применения дорогостоящих методов лучевой диагностики. При острых и хронических воспалительных нейропатиях данный способ может являться дополнительным методом контроля в динамике за состоянием периферических нервов, так как структурные изменения нервов не имеют прямой корреляционной связи с клиническими проявлениями и данными проводимости. А именно при хронических воспалительных полинейропатиях структурные изменения носят длительный характер и степень их поражения не зависят от клинических проявлений, то есть часто при отсутствии четкой клиники выявляются выраженные симметричные проксимальные структурные изменения нервов.
Способ оценки характера поражения периферической нервной системы при сенсомоторных невропатиях, включающий проведение ультразвукового исследования структуры нервов верхних и нижних конечностей, отличающийся тем, что исследование структуры нервов конечности проводят на всем их протяжении и при нарушении кабельности строения на всем протяжении и снижении их эхогенности характер поражения оценивают, как диффузный пролонгированный; при нарушении кабельности строения нервов на уровне сегмента конечности и снижении их эхогенности - характер поражения оценивают как сегментарный; при нарушении кабельности строения в симметрично расположенных одноименных нервах верхних или нижних конечностей и снижении их эхогенности - характер поражения оценивают как симметричный; при нарушении кабельности строения одного из симметричных нервов верхних или нижних конечностей и снижении в них эхогенности - характер поражения оценивают как асимметричный.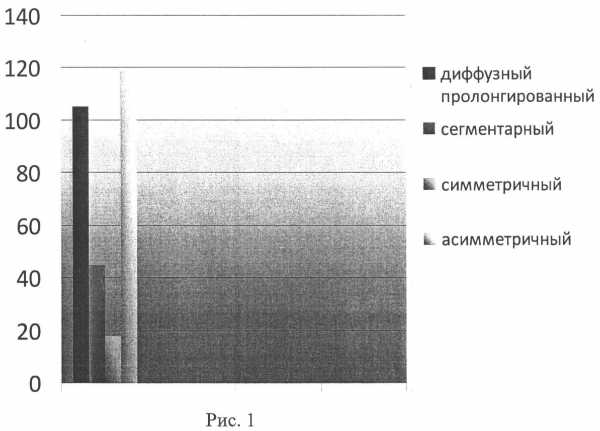
edrid.ru
Полинейропатия диабетическая нижних конечностей: что это такое?
Полинейропатия – что это такое? Сама частица «нейро» в названии диагноза как бы намекает, что это осложнение связано с нервами. Это действительно так, но полное название этого осложнения звучит так: дистальная симметричная сенсомоторная диабетическая полинейропатия. По этому названию можно устраивать прогулки как по музею. Каждое слово и даже его часть несут врачам важную информацию. Для того чтобы понять, что это за осложнение, можно разобрать значение диагноза в буквальном смысле по словам.
Дистальная
Этот термин означает, что при сахарном диабете поражается нервная система, расположенная дистально, то есть подальше от тела и внутренних органов. Этот термин противоположен по значению слову «проксимальная», то есть ближайшая. То есть, это «окончания» тела. В неврологии существует хорошее образное выражение: поражение по типу носков и перчаток. Именно в этих местах повышенный уровень сахара крови производит наибольший вред нервам. Это происходит оттого, что на периферии у нервов тоньше миелиновая оболочка (потому что сами нервы тоньше, как длинные веточки), которая является «изолятором» нервного волокна. Она более уязвима в отношении губительного действия сахара. Кроме того, именно на периферии часто возникают нарушения кровоснабжения. Поэтому дистальная форма заболевания – самая часто встречающаяся.
Симметричная
Симметрия – это важный признак системного поражения. Если признаки полинейропатии возникают только на одной ноге, то это значит, что произошла какая-то катастрофа с нервами именно в данном месте: возникла компрессия, травма нерва или другой патологический процесс. Симметричность поражения говорит о том, что виновата кровь, которая, омывая одинаково руки и ноги, содержит вещество, которое приносит вред. В данном случае виновата хроническая, многолетняя гипергликемия – повышенное содержание сахара в крови. Пациенты ощущают, что ноги и руки страдают почти одинаково.
Сенсомоторная
В это слово включен смысл поражения. Сенсомоторная – означает сенсорная плюс моторная форма, то есть нарушение чувствительности (сенсорные расстройства), которое сочетается с моторными нарушениями, то есть расстройствами движения. Конечно, на стопах и в области голеностопного сустава, также как на кистях и пальцах рук, различные нервы «заведуют» проведением чувствительности, а также посылают двигательные импульсы к мышцам. Но все они в равной степени страдают от избытка сахара и начинают «плохо работать». В частности, чувствительные нарушения проявляются:
- Общим снижением чувствительности (гипестезией). Пациент не может понять, за какой палец ноги взял его врач, если не смотреть и не шевелить ногой.
- Появляются парестезии (ощущение ползания мурашек), может возникать онемение.
- Наиболее мучительным ощущением является гиперпатия – извращенная чувствительность, при которой возникает мучительное ощущение жара в стопах. Они не болят, а как бы «горят». Пациент с полинейропатией старается ночью высунуть ноги из-под одеяла, часто идет в ванную и смачивает их холодной водой. Пока стопы влажные, все хорошо. Стоит им высохнуть, как опять появляются неприятные ощущения.
 Двигательные (моторные) расстройства проявляются угнетением или полным отсутствием сухожильного ахиллова рефлекса, но наиболее часто возникает слабость в стопах. Если попросить пациента с полинейропатией постараться пройтись на цыпочках, а затем – на пятках, то скорее всего у него ничего не получится либо выйдет очень неустойчиво и коряво: мышцы не работают. И не потому, что они парализованы, а потому, что нерв не может провести полноценный двигательный импульс, так как он «отравлен» глюкозой.
Двигательные (моторные) расстройства проявляются угнетением или полным отсутствием сухожильного ахиллова рефлекса, но наиболее часто возникает слабость в стопах. Если попросить пациента с полинейропатией постараться пройтись на цыпочках, а затем – на пятках, то скорее всего у него ничего не получится либо выйдет очень неустойчиво и коряво: мышцы не работают. И не потому, что они парализованы, а потому, что нерв не может провести полноценный двигательный импульс, так как он «отравлен» глюкозой.
Полинейропатия
Собственно, этот термин и обозначает, что поражен не головной или спинной мозг, а множество нервов на периферии (поли – означает много). Именно такой «рассыпной» тип поражения характерен для полинейропатии. Поражения по типу «носков» и «перчаток», кроме диабета, характерны для отравления солями тяжелых металлов (свинцовая) или вследствие длительного злоупотребления алкоголем (алкогольная форма).
Нижние конечности
Почему задействованы ноги? На самом деле, симптомы нейропатии при диабете проявляются и в руках, но в ногах они протекают более выражено. Этому есть причины:
- Именно в ногах, в пожилом возрасте, когда обычно и возникает данная симптоматика, уже существуют предпосылки в виде нарушения кровообращения: варикоза, эндартериита, тромбофлебита.
- Кроме того, ноги постоянно нагружаются совсем не так, как руки, ведь при ходьбе руки отдыхают.
- Часто у пациентов, особенно со вторым типом сахарного диабета, бывает избыток веса, который также неблагоприятно сказывается на здоровье ног.
Теперь каждый знает, что обозначает этот сложный диагноз. Лечение диабетической полинейропатии не менее сложное: нельзя в один день или даже месяц полностью ликвидировать токсическое поражение глюкозой нервов, которое длилось годами. Существуют многие схемы терапии. Для этого, например, используют внутривенные инфузии «Берлитиона» и других препаратов тиоктовой кислоты.
В терапии полинейропатии большое значение имеют средства для нормализации микроциркуляции («Пентоксифиллин», «Трентал»), витамины группы «В», лучше в виде комбинированного препарата, например, «Мильгамма». Также применяют физиотерапевтические процедуры, например, электрофорез тиамина или дибазола. При полинейропатии очень важно соблюдать гигиену стоп, не допускать появление ранок, порезов и мозолей, поскольку плохая заживляемость ран при диабете в сочетании с полинейропатией может привести к появлению «диабетической стопы», что чревато в запущенных случаях даже ампутацией.
Лечиться можно и народными средствами, но только при разрешении и одобрении лечащего врача, поскольку одни средства народной медицины не в состоянии справиться с этим осложнением. Важно знать, что первым и важнейшим условием значительного улучшения самочувствия при этом осложнении сахарного диабета является достижение нормогликемии, то есть длительного снижения уровня сахара крови до нормальных значений.
prodiabet24.ru
Диабетическая нейропатия: классификация, диагностика и лечение
Определение диабетической нейропатии
Наличие признаков и/или симптомов, свидетельствующих о поражении периферического отдела нервной системы у лиц с сахарным диабетом (СД), с учетом исключения других причин нейропатии. Диагноз диабетической нейропатии может быть установлен при тщательном обследовании пациента. Отсутствие симптомов нейропатии не является основанием для исключения диагноза, в то же время диагноз диабетической нейропатии не может быть установлен при наличии единственного симптома или признака. Согласно современным рекомендациям, необходимо минимум два неврологических нарушения (симптомы, изменение скорости распространения возбуждения по нервному волокну, сдвиги по данным количественных сенсорных или автономных тестов) для постановки диагноза диабетической нейропатии.
Современная классификация диабетической нейропатии
Генерализованные симметричные полинейропатии
Сенсомоторная (хроническая)
Сенсорная (острая)
Гипергликемическая нейропатия
Автономная нейропатия
Фокальные и мультифокальные нейропатии
Краниальные
Пояснично-грудная радикулонейропатия
Фокальные тоннельные нейропатии
Проксимальная моторная нейропатия (амиотрофия)
Хроническая воспалительная демиелинизирующая нейропатия (Chronic inflammatory demyelinating neuropathy — CIDP)
Хроническая сенсомоторная нейропатия
Наиболее частой формой диабетической нейропатии является хроническая сенсомоторная нейропатия. Проявлениями данной формы поражения являются положительные неврологические симптомы, возникающие или усиливающиеся в ночное время суток или в состоянии покоя. «Отрицательная» симптоматика (онемение или утрата устойчивости при ходьбе) присуща тяжелым стадиям нейропатии. Снижение проприоцептивной чувствительности и сенсорной иннервации мышц стопы в сочетании с повторяющейся малой травматизацией лежит в основе формирования нейроостеоартропатии (стопа Шарко). Проявлением тяжелой стадии сенсомоторной нейропатии является характерная деформация стопы (pes cavus) и пальцев, которой часто сопутствует выраженное ограничение подвижности суставов стопы.
Острая сенсорная нейропатия
Острая сенсорная нейропатия характеризуется выраженной сенсорной симптоматикой (гиперестезия, дизестезия, аллодиния). При этом могут оставаться сохранными различные виды чувствительности и рефлексы. Болевая симптоматика отличается достаточной выраженностью, может сочетаться со значительной потерей массы тела пациента и развитием депрессивных расстройств. Чаще всего острая сенсорная нейропатия развивается при резком изменении показателей гликемии как в сторону их ухудшения (состояние кетоацидоза), так и при быстром улучшении гликемического контроля в ответ на назначение сахароснижающей терапии инсулином или пероральными сахароснижающими препаратами (инсулиновые невриты). Патогенетической основой в данном случае является формирование артериовенозных шунтов и образование «новых» сосудов в системе интраневрального кровотока, что обусловливает состояние хронической ишемии нерва.
Гипергликемическая нейропатия
Быстро обратимые неврологические нарушения, включая умеренно выраженную сенсорную симптоматику и нарушение скорости распространения возбуждения по нервным волокнам, имеют место у лиц с впервые выявленным СД, пациентов с транзиторным ухудшением состояния гликемического контроля. Нормализация показателей гликемии способствует облегчению тяжести неврологической симптоматики и улучшению состояния больных.
Автономная нейропатия
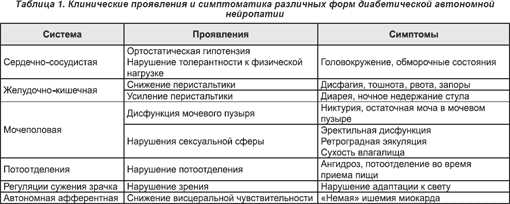
Проявления диабетической автономной нейропатии встречаются достаточно часто, наиболее тяжелые из них определяют высокий уровень заболеваемости и летальности среди больных СД. Наиболее частые и характерные формы автономной нейропатии представлены в табл. 1.
Согласно тяжести проявлений диабетической нейропатии различают несколько ее стадий (табл. 2).
Фокальные и мультифокальные нейропатии
Тоннельные нейропатии возникают чаще всего у лиц с СД типа 2 в пожилом и преклонном возрасте. Наиболее частой формой является тоннельная нейропатия запястного канала вследствие сдавливания срединного нерва поперечной связкой запястья. Нейрофизиологические признаки выявляются у 20-30% больных, в то время как симптоматика имеет место лишь у 5,8%. Болевые ощущения в виде парестезии и дизестезии пальцев могут усиливаться по мере прогрессирования, иррадиировать в предплечье и плечо, болевые ощущения усиливаются в ночное время. Во избежание прогрессирующей демиелинизации нервного волокна проводятся инъекции глюкокортикоидов в область запястного канала, в ряде случаев осуществляется хирургическая декомпрессия путем перерезки поперечной связки запястья. Данное лечение в значительной степени облегчает болевую симптоматику, однако не всегда предотвращает дальнейшую атрофию мышц кисти и утрату чувствительности. Тоннельная нейропатия локтевого нерва развивается у 2,1% больных, сопровождается болевыми ощущениями и парестезией IV и V пальцев руки, сочетается с атрофией мышц кисти в области hypothenar. Предпочтительной является консервативная терапия глюкокортикоидами. Хирургические методы лечения применяются редко ввиду их малой эффективности.
Краниальные нейропатии
Краниальные нейропатии встречаются крайне редко (0,05%), в основном у лиц старческого возраста и пациентов с большой длительностью заболевания.
Диабетическая амиотрофия
Диабетическая амиотрофия встречается у лиц с СД типа 2 в возрастной группе 50-60 лет. Определяющей в клинической картине является тяжелая болевая симптоматика, носящая одно- или двусторонний характер, сопровождаемая атрофией мышц бедра. При нейрофизиологическом обследовании выявляются изменения амплитуды М-ответа, снижение скорости проведения по n. quadriceps. Исследованиями последних лет показано, что у больных с диабетической амиотрофией имеет место окклюзия эпиневральных кровеносных сосудов с развитием некротизирующего васкулита, инфильтрацией нерва клетками воспаления и гемосидерином. Основным методом лечения диабетической амиотрофии является иммуносупрессивная терапия с использованием внутривенных вливаний высоких доз кортикостероидов или иммуноглобулина.
Диабетическая радикулонейропатия
Диабетическая радикулонейропатия поражает лиц с СД среднего и пожилого возраста. Боли носят опоясывающий характер, локализуются на уровне грудной клетки и/или брюшной стенки. Клиническое обследование больного выявляет гетерогенность неврологических проявлений от отсутствия признаков до нарушенной чувствительности и гипералгезии. Улучшение гликемического контроля может способствовать разрешению клинической симптоматики. В ряде случаев возникает необходимость назначения иммуносупрессивной терапии.
Хроническая воспалительная демиелинизирующая полинейропатия
Подозрение на хроническую воспалительную демиелинизующую полинейропатию (ХВДП) может возникнуть при быстро прогрессирующем характере развития полинейропатии. На сегодняшний день четких дифференциально-диагностических критериев, позволяющих отличить диабетическую полинейропатию от ХВДП, нет. Лечебное воздействие заключается в длительной иммуномодулирующей терапии с использованием кортикостероидов, азатиоприна, плазмафереза и внутривенных вливаний иммуноглобулина. Активная тактика ведения данной категории больных позволяет уменьшить проявления неврологического дефицита и замедлить прогрессирующее ухудшение электрофизиологических параметров.
Диагностика диабетической нейропатии
Признаки нейропатии, выявляемые при обследовании больного
Неврологическое обследование пациентов включает оценку различных видов чувствительности (болевая, тактильная, вибрационная, чувство давления, холодовая, тепловая, проприоцепция), а также ахиллова и коленного рефлексов (табл. 3).
Важно отметить, что с учетом большой вероятности изолированного поражения отдельных нервных волокон, ответственных за определенные виды чувствительности, осмотр пациента должен включать оценку всех перечисленных видов чувствительности.
Симптомы диабетической нейропатии могут быть оценены с использованием специальных опросников или шкал, таких как шкала неврологических симптомов, общая шкала симптомов, Мичиганская шкала неврологических симптомов и т.д. Типичные нейропатические симптомы представлены в табл. 4.
Многие пациенты имеют как положительную, так и отрицательную симптоматику.
Использование комбинированной шкалы различных видов чувствительности и рефлексов позволяет получить количественное выражение состояния периферической нервной системы и оценить степень развития неврологического дефицита. Наиболее широко используется шкала неврологических расстройств (табл. 5).
Количественная оценка чувствительности позволяет контролировать интенсивность подачи стимула и получить значение порога болевой, температурной и вибрационной чувствительности в параметрических единицах. Сравнение полученных значений с нормативными показателями позволяет количественно оценить состояние различных видов чувствительности на субклинических стадиях диабетической нейропатии. Несмотря на определенные ограничения, данная методика стала широко применяться в исследовательских целях для ранней диагностики диабетической нейропатии.
Нейромиография. Исследование периферической нервной системы с помощью нейромиографии осуществляется с целью получения наиболее объективной информации о состоянии крупных миелинизированных нервных волокон. Показано, что скорость распространения возбуждения (СРВ) по нервным волокнам у больных СД снижается приблизительно на 0,5 м/с/ч. В исследовании DCCT за 5-летний период наблюдения снижение СРВ по икроножному нерву составило 2,8 м/с, по малоберцовому нерву — 2,7 м/с. В то же время в группе интенсивного наблюдения лишь у 16,5% больных отмечено значительное ухудшение показателей СРВ, в группе традиционного лечения — у 40,2%. Регрессионный анализ показал, что изменение уровня гликированного гемоглобина на 1% ассоциируется с отклонением СРВ на 1,3 м/с.
Биопсия икроножного нерва проводится для диагностики атипичных форм нейропатии, а также в ряде клинических исследований, в которых оценивается эффективность патогенетической терапии нейропатии.
Биопсия кожи позволяет получить морфологическую картину, количественно отражающую состояние иннервации кожи мелкими нервными волокнами. Показано, что данная методика имеет высокую чувствительность, поскольку изменения выявляются даже у пациентов с нарушением толерантности к глюкозе, у лиц без признаков поражений нервной системы по данным нейромиографии или количественных методов оценки чувствительности.
Магнитно-резонансная томография (МРТ) используется для оценки степени вовлеченности спинного мозга в развитие изменений периферической нервной системы. По данным исследований, у пациентов с субклинической стадией нейропатии выявляются изменения в области спиноталамического тракта и таламуса.
Лечение и профилактика
На сегодняшний день основным патогенетически оправданным и клинически подтвержденным методом лечения и профилактики диабетической полинейропатии является достижение и поддержание оптимального (НbА1с < 6,5%) гликемического контроля (DCCT, SDIS, Oslo Study, Kumamoto Study). В то же время в реальной клинической практике идеальная компенсация углеводного обмена, поддерживаемая в течение длительного периода времени, осуществима лишь у небольшого числа пациентов. Следует также учитывать прогрессирующий характер заболевания, что определяет неуклонный рост числа случаев развития хронических осложнений с увеличением длительности диабета. Следовательно, крайне актуальным является возможность использования лекарственных препаратов, влияющих на различные звенья патогенеза диабетической нейропатии.
Ингибиторы альдозоредуктазы
Первые клинические исследования по оценке эффективности этой группы препаратов стали проводиться 25 лет назад. Однако на сегодняшний день единственный из этой группы препарат эпалрестат разрешен для клинического применения только в Японии. Большинство клинических испытаний по ряду причин не подтвердили значимого эффекта в отношении улучшения или профилактики развития диабетической нейропатии. Многие из предложенных субстанций обладали высокой гепатотоксичностью, что ограничивало их длительное применение в клинической практике.
Антиоксиданты
Роль окислительного стресса в патогенезе развития диабетической нейропатии не вызывает сомнений. Исследования по оценке эффективности наиболее действенного антиоксиданта — α-липоевой кислоты (Эспа-липон) показали потенциальные возможности препаратов данной группы. Препараты α-липоевой кислоты способны снижать уровень глюкозы, уменьшать инсулинорезистентность. Кроме того, они обладают гепатопротекторным действием.
Исследованиями ALADIN и SYDNEY показано, что применение внутривенных вливаний 600 мг α-липоевой кислоты в течение 3 недель сопровождается значительным улучшением неврологической симптоматики у больных с болевой формой диабетической полинейропатии. В настоящее время подходят к завершению два крупных многоцентровых исследования в Европе и странах Северной Америки по оценке эффективности α-липоевой кислоты при лечении диабетической нейропатии. Препараты α-липоевой кислоты выпускаются как в инфузионной, так и в таблетированной форме. Важно отметить, что стандартным курсом лечения является инфузионное введение препарата в дозе 600 мг в сутки внутривенно капельно на 150,0 мл 0,9% раствора NaCl в течение 3 недель (с перерывами в выходные дни) с последующим пероральным приемом препарата в течение 2-3 месяцев по 600 мг в сутки. Учитывая фармакокинетические особенности всасывания таблетированных форм α-липоевой кислоты в кишечнике, прием таблеток рекомендуется осуществлять не менее чем за 30 мин до приема пищи.
Ингибиторы протеинкиназы С (PKC)
Внутриклеточная гипергликемия повышает уровень диацилглицерола, который, в свою очередь, активирует образование PKC, что приводит к нарушению экспрессии эндотелиальной синтазы оксида азота и сосудистого эндотелиального фактора роста. Данные предварительных исследований по применению ингибитора изоформы PKC показали его положительное влияние на функциональное состояние периферической нервной системы. Многоцентровые исследования по препарату будут завершены к концу 2006 г.
В ряде случаев, при наличии выраженной болевой симптоматики, возникает необходимость назначения симптоматической терапии. Все препараты симптоматического действия влияют на те или иные патогенетические механизмы формирования хронического болевого синдрома, обладают дозозависимым эффектом и во избежание рецидивов боли назначаются в течение длительного периода времени.
Стадия осложнений диабетической нейропатии
Наиболее опасным осложнением диабетической дистальной полинейропатии является синдром диабетической стопы. Роль нейропатии как этиопатогенетического фактора развития язвенных дефектов стоп и остеоартропатии (cтопа Шарко) подтверждена многочисленными исследованиями. Вместе с этим показано, что образование язвенного дефекта у пациентов с выраженным неврологическим дефицитом не происходит спонтанно, а является результатом воздействия внешних и/или внутренних факторов на нейропатическую стопу. К внешним факторам относятся тесная обувь, механические и термические внешние воздействия. Внутренние факторы во многом обусловлены повышенным подошвенным давлением, образованием участков омозолелостей, формированием деформации пальцев и стопы в целом. Специальные программы обучения, активного наблюдения больных группы высокого риска развития язвенных дефектов, специализированная педиатрическая помощь и терапевтическая, ортопедическая обувь существенно уменьшают частоту язвенных дефектов и ампутаций нижних конечностей у больных СД.
Bibliography1. Дедов И.И., Шестакова М.В. Сахарный диабет. Руководство для врачей. — Универсум Паблишинг, 2003. — С. 269-78.
2. Дедов И.И., О.В. Удовиченко, Галстян Г.Р. Диабетическая стопа. — Практическая Медицина, 2005. — С. 48-57.
3. Галстян Г.Р., Анциферов М.Б. Лечение диабетической полинейропатии // Врач. — 2000. — 23-9.
4. Thomas P.K. Classification of the diabetic neuropathies // Textbook of Diabetic Neuropathy / Gries F.A.E, Low P.A., Ziegler D., Eds. — Stuttgart: Thieme, 2003. — Р. 175-7.
5. Dyck P.J. // Textbook of Diabetic Neuropathy / Gries F.A.E, Low P.A., Ziegler D., Eds. — Stuttgart: Thieme, 2003. — Р. 170-5.
6. Said G. Different patterns of neuropathies in diabetic patients // Diabetic Neuropathy / Boulton A.J.M., Ed. — Cologne, Aventis, Academy Press, 2001. — Р. 16-41.
7. Mendell J.R., Sahenk Z. Painful sensory neuropathy // N Engl J Med. — 2003. — 1243-55.
8. Vinik A.I., Park T.S., Stansberry K.B., Pittenger G.L. Diabetic neuropathies // Diabetologia. — 2000. — 43. — 957-73.
9. Jude E.B., Boulton A.J.M. End-stage complications of diabetic neuropathy // Diabetes Rev. — 1999. — 7. — 395-410.
10. DCCT Research Group: The effect of intensive diabetes therapy on the development and progression of neuropathy // Ann Int Mеd. — 1995. — 122. — 561-8.
11. Boulton A.J.M., Rayaz Malik, Arezzo J.C.A., Sosenko J.M. Diabetic Somatic Neuropathies // Diabetes Care. — 2004. — 27. — 1458-86.
12. Litchy W., Dyck P.J., Tesfaye S., Zhang D. DPN assessed by neurological examination and composite scores is improved with LY333531 treatment // Diabetes. — 2002. — 45 (Suppl. 2). — S197.
www.mif-ua.com