Большая Энциклопедия Нефти и Газа. Железо двухвалентное железо трехвалентное
Железо двухвалентное железо трехвалентное. Очистка воды от железа. Обзор методов
- Личный кабинет
- Нейротехнологии.рф
- Главная
- Что это за сайт?
- Что такое нейротехнологии?
- Новости сайта
- Глоссарий терминов
- Команда
- Контакты и связь
- Статьи и публикации
- Все статьи
- Лечебная диета
- Причины заболеваний
- Свойства лекарств
- Поджелудочная железа
- Советы врачей
- Нейроновости
- Познавательные видео
- Мероприятия
- Документы
xn--c1adanacpmdicbu3a0c.xn--p1ai
Фильтра для двухвалентного железа и не только

Фильтрационные особенности очищения воды от железа основываются на многих факторах. Известный факт, что живое существо, в том числе и люди не могут протянуть и пары дней без воды. Однако небезопасно пить воду, содержащую такие элементы как хлорные соединения, кальций и железо выше допустимой нормы. Если из краника течет вода, полная ржавчины, а на раковине появились коррозийные подтеки, то вода содержит в избыточном количестве примеси железа. Хочется рассмотреть, какие способы очистки воды от данного вещества существуют. Чтобы выбрать корректное фильтрующее оборудование, необходимо учитывать некоторые факторы.
Отличительные особенности фильтра для двухвалентного железа или железо бывает разное
 В воде может присутствовать три типа разного железа, которое есть в воде:
В воде может присутствовать три типа разного железа, которое есть в воде:
1) Fe+2 или формула двухвалентного металла. Вода, содержащее двухвалентное железо, прозрачна, поэтому примеси этого вещества нельзя увидеть невооруженным глазом. А вода, когда окисляется, она приобретает мутно-рыжий цвет. Причина в том, что железо переходит в трехвалентную форму.
2) Fe+3 или трехвалентное железо. От двухвалентного оно отличается содержание этого типа железа в воде, образовывают множество частиц ржавого цвета, часто присутствует осадок. Также в такой воде может содержаться и форма двухвалентного железа.
3) Бактериальное железо — слизеобразная мягкая форма, состоящая из бактерий (живых и мертвых), их продуктов жизнедеятельности и оболочек. Часто сопровождается минеральными отложениями Fe3+. Существует вероятность, что эта вода может принести вред, как и человеку, так и трубам и фильтр от него пострадает.
Какие фильтра для двухвалентного железа самые лучшие?
Если необходимо очистить воду от двухвалентного железа, рекомендуется использовать проверенные способы фильтрации воды от растворенных неорганических ионов — обратный осмос и ионный обмен. Чтобы удалить не растворенное железо двухвалентной формы, необходимо использовать систему ультрафильтрации. Эти способы имеют свои плюсы и минусы, поэтому рассмотрим их подробно:
— обратный осмос — самый эффективный способ удаления очистки растворенного железа, как и Fe+2 (двухвалентного), так и Fe+3 (в невысоких концентрациях). Железо продавливается через специальную мембрану фильтра для двухвалентного железа, которая препятствует проходу даже мелким частицам. Сама мембрана устойчива к закупориванию, поэтому примеси не задерживаются на ней, а сливаются в дренаж с концентратом. Это свойство делает систему обратного осмоса и фильтр для двухвалентного железа уникальной в своем роде. Если при рН=7, вода, содержащая железо до 10-20 мг/л, фильтруется, показывая прекрасный результат, то говорить о показателях при более низких рН нет смысла. Несомненным плюсом этой системы очистки является эффективность удаления одного их самых распространённых сопровождающих веществ железа – марганца. Существует одно очень важное условие для работы обратного осмоса – никакого кислорода. При его наличии, образуется и окисляется дисперсное железо на мембране, которое приводит в износ фильтр и оборудование. Но это не является проблемой, поскольку системы обратного осмоса обладают свойством герметичности;
— ионный обмен — катионообменная смола – основная составляющая для эффективной очистки двухвалентного железа (при его низкой концентрации 1-2 мг/л). Но есть минусы этой системы очистки. Во-первых, смола со временем загрязняется, а значит, ее необходимо менять. Во-вторых, существует вероятность перехода двухвалентного железа в трёхвалентную форму, с которой этот метод очищения не справляется;
— очистка воды, удаление двухвалентного металла в процессе окисления.
Один из самых распространённых способов фильтрации – использование фильтрующей среды greensand, которая эффективна при содержании вещества до 10-15 мг/л, рН (бо6лее 7) и невысоком содержании сероводорода и марганца. Секрет в том, что в состав системы фильтрации входит перманганат калия (марганцовка), который необходим для регенерации воды. При взаимодействии с Greensand, железо в воде окисляется, а затем в процессе обратной промывки с помощью фильтра вымывается. Минусом этого метода, является то, что при сбое работы, перманганат калия может попасть в очищенную воду;
— диоксид марганца — метод очистки диоксидом марганца эффективен при невысоких концентрациях Fe, сероводорода и марганца, а также и при рН не менее 7. Обязательным условием становится предварительное окисление Fe;
— Birm — способ фильтрации Birm по работе напоминает метод удаления железа диоксидом марганца, но не удаляет из воды сероводород;
— Redox (окислительно-восстановительная среда) — Redox эффективно удаляет такие элементы как железо, сероводород и железобактерии, но не оказывает воздействия на марганец. В состав этой фильтрующей среды входит два металла: 85% меди и 15% цинка. Эти элементы, взаимодействуя друг с другом, образуют маленькое электрическое поле, которое препятствует росту бактерий. Недостаток этого метода – большой вес, при котором скорость потока в два раза меньше, чем у других минералов;
— предварительное окисление железа — перед тем как подавать воду в фильтр для фильтрации, часто используется процедура окисления Fe, которая достигается с помощью хлорирования, аэрации, введения пероксида водорода, озонирования. Этот метод рекомендуется при рН больше 6,5. Чем выше этот показатель, тем лучше, потому что двухвалентное железо быстро превратится в трехвалентное, а значит и быстрее окислится.
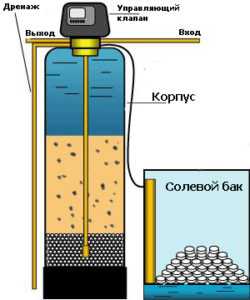
Фильтр обезжелезиватель
Самыми распространенными проблемами поломки фильтров-обезжелезивателей, являются неправильные выставленные параметры низкой скорости потока при обратной промывке или неполное окисление Fe, поэтому важно строго следовать рекомендациям производителя, а также не помешает читать инструкцию перед установкой фильтра. Особенно, когда нужно устанавливать скорость потока при обратной промывке, содержание входного металла и другие ограничения, которые указывает производитель для стабильной работы аппаратуры. Также важным параметром эффективной работы при выборе фильтра окисления железа с последующей фильтрацией являются учет рН, температуры воды, содержания растворенного кислорода, щелочности и других факторов.
Как очистить воду от трехвалентного металла Fe?
Самый результативный способ удаления трехвалентного железа из воды – система ультрафильтрации, а не стандартный фильтр. Размер пор мембраны этой системы, имеющей режимы обратной промывки и периодического сброса концентрата, составляет около 0,05 микрон, что отлично подходит для задержки коллоидного Fe. Особенно этот способ продуктивен при удалении окисленного вещества.
Очистка воды при содержании бактериального железа
Для эффективного очищения воды от бактериального железа (на ранней стадии обнаружения) используют регулярное хлорирование или обработку хелатными агентами. Хелатные агенты — это органические вещества, которые образуют растворимые комплексы с железными отложениями.
При использовании хлорирования создается высокая концентрация этого элемента (50 мг/л), но, чтобы не испортить оборудование водоочистки и фильтр, нужно выяснить, насколько оно устойчиво к хлору.
Также можно использования среду redox, однако, проблема не будет решена полностью, так как в подводящих трубопроводах бактерии будут продолжать размножаться и расти, образовывая слизистые отложения.
Чтобы удалить железо двухвалентной формы или трехвалентной формы, но в небольших концентрациях, лучшим вариантом будет использование фильтра обратного осмоса. Если концентрация трехвалентного металла выше допустимого значения, то эффективно применение систем ультрафильтрации.
Вконтакте
Google+
voday.ru
Окисление - двухвалентное железо - Большая Энциклопедия Нефти и Газа, статья, страница 1
Окисление - двухвалентное железо
Cтраница 1
Окисление двухвалентного железа в трехвалентное ускоряется в присутствии пиролюзита, а также окислов марганца, которыми обрабатывают кварцевый песок и получают так называемый черный песок. Обрабатываемую воду фильтруют сначала через омарганцованный песок ( или; пиролюзит), а затем через обычный песок. [1]
Окисление двухвалентного железа в трехвалентное может быть осуществлено в щелочной среде большинством окислителей и кислородом воздуха; в кислой среде-азотной кислотой, бертолотовой солью, кислородом воздуха. [2]
Окисление двухвалентного железа в трехвалентное может быть осуществлено в щелочной среде большинством окислителей и кислородом воздуха; в кислой среде-азотной кислотой, хлорной кислотой, кислородом воздуха. [3]
Для окисления двухвалентного железа и нитритов иногда обрабатывают пробу перманганатом. Однако этот метод непригоден при наличии больших количеств органических веществ. [4]
Для окисления двухвалентного железа, а также многих органических примесей применяют хлорирование воды. Введение извести позволяет провести процессы нейтрализации и коагулирования, а также ускорить процесс осаждения гидроокиси железа. [5]
Скорость окисления двухвалентного железа при аэрации воды с интенсивностью подачи воздуха 8 л / мин может быть примерно определена по экспериментальному графику Рюммеля [52], показанному на рис. VII.2. Из графика видно, что для полного окисления 550 мг Fe2 требуется проводить аэрацию в течение 14 мин. В ходе аэрации происходит временное снижение рН воды ( от 8 05 до 7 35), которое Рюммель объясняет тем, что реакция гидролиза Fe2 с выделением водорода протекает быстрее, чем нейтрализация Н добавленной известью. После завершения гидролиза величина рН повышается. [7]
Процесс окисления двухвалентного железа до трехвалентного предполагает наличие кислорода в растворе. Для дозиметрического раствора, насыщенного воздухом, этот предел составляет около 50 000 рад; практически рабочий интервал равен 4000 - 40 000 рад. При насыщении раствора чистым кислородом определяемая доза возрастает в четыре раза. [8]
Аналогично проходит окисление двухвалентного железа. [10]
Произошел процесс окисления двухвалентного железа в трехвалентное под действием азотной кислоты, весьма сильного окислителя. [11]
Поскольку процесс окисления двухвалентного железа в трехвалентное, значительно замедляющийся при рН ниже 7, может вообще не закончиться на очистных сооружениях, удаление СО2 ( последняя образуется в приведенной выше реакции гидролиза в значительном количестве и приводит к снижению рН) является в ряде случаев необходимым этапом обезжелезивания. Если рН воды после гидролиза не падает ниже 7, воздух вводят в воду в таком количестве, которое необходимо лишь для окисления. Это осуществляется введением его во всасывающий патрубок насоса или эжектированием в трубопровод перед фильтрами. [12]
Это объясняется окислением двухвалентного железа в трехвалентное при длительном выветривании ильменита. [13]
Например, для окисления двухвалентного железа, содержащегося в 200 мг FeSO4 - 7h3O, необходимо около 5 8 мг кислорода. [14]
Бром прибавляется для окисления двухвалентного железа и разрушения избытка оксалата аммония, азотная кислота - для окисления сульфид-иона. Окончательная очистка нитрата стронция достигается перекристаллизацией. [15]
Страницы: 1 2 3 4
www.ngpedia.ru
Железо трехвалентное, соединения - Справочник химика 21
Реакции не мешают бензол, циклогексан, капролактам, циклогексанон, циклогексанол и нитробензол. Мешают определению вещества, образующие с ионами трехвалентного железа окрашенные соединения (например, фенолы). [c.220]
Окислительный потенциал трехвалентного железа при переходе в двухвалентное ( =0,77 й) довольно близок к потенциалу перехода дифениламина Еинд =0,76). Поэтому дифениламин частично окисляется ионами трехвалентного железа. Эта реакция протекает медленно, но тем не менее окраска дифениламина возникает еще до точки эквивалентности, так как при титровании концентрация ионов трехвалентного железа все больше увеличивается. Чтобы избежать этого, к раствору перед титрованием приливают НдРО,. Фосфорная кислота образует с ионами трехвалентного железа комплексное соединение [c.395]
Образующиеся гидроксамовые кислоты дают с трехвалентным железом комплексное соединение, окрашенное в красно-коричневый цвет. Интенсивность окраски раствора пропорциональна содержанию в нем гидроксамовой кислоты. [c.48]
Если известно, какие именно примеси присутствуют в растворе, то можно испытать, будут ли они мешать титрованию, произведя титрование смесей известного количественного состава. Если мешающее влияние обнаружено, то соответствующие соединения надо предварительно удалить или обезвредить. Так, например, трехвалентное железо, мешающее титрованию иода тиосульфатом, можно обезвредить добавлением фторида, образующего с железом комплексное соединение. [c.15]
Кроме соединений двух- и трехвалентного железа, известны соединения шестивалентного железа — ферраты (соли железной кислоты). [c.229]
Биохимическая очистка нефтесодержащих сточных вод по методу Юнга (двухступенчатая очистка в аэротенках с подачей реагентов в первую ступень), широко применяемая на зарубежных НПЗ [82], хотя и была запроектирована для двух НПЗ, однако метод не был испытан в производственных условиях и на отечественных НПЗ не применяется. На некоторых предприятиях перед биохимической очисткой сточные воды подвергают предварительной обработке химическими реагентами (сульфатом железа и известью). По рекомендациям института ВНИИПКнефтехим, вместо сульфата железа применяют отходы производства диоксида титана, содержащие 97—99% двух- и трехвалентных соединений железа [83]. [c.131]
Примером последнего могут служить окисление железа и марганца бактериями. Так, железобактерии получают энергию в результате окисления солей двухвалентного железа до соединений трехвалентного железа [c.242]
Оксихинолин отличается от других оксихинолинов пространственным расположением гидроксильной группы по отношению к азоту кольца. В результате такого расположения ионы многих металлов образуют с 8-оксихинолинами нерастворимые клешнеобразные соединения. Такие металлы, как медь, цинк, кадмий, алюминий, висмут, уран, марганец, железо (трехвалентное) и никель, наряду с некоторыми другими, осаждаются в виде клешнеобразных соединений с 8-оксихинолином из его раствора, содержащего уксуснокислый натрий. Вследствие этого 8-оксихинолин является одним из наиболее ценных органических реагентов для определения металлических ионов. Это соединение известно также под названием оксина оно было предложено в качестве аналитического реактива Ханом [449] и Бергом [450]. Имеются хорошие обзоры работ с применением этого реагента [4506, 451]. [c.104]
Элементарная сера в растворе ацетона быстро и количественно реагирует с цианидом, образуя роданид. При последующем добавлении хлорида трехвалентного железа образуется соединение, поглощение которого можно измерить при 465 ммк. Метод применим для определения элементарной серы в углеводородах [7[ и имеет чувствительность [c.326]
Токсичность некоторых ядов может увеличиваться не только при взаимодействии с другими веществами, но и за счет их превращений непосредственно в организме. Так, например, отравляющее действие этиленгликоля, поступающего в организм, объясняется его окислением в щавелевую кислоту, которая является более токсичным продуктом. Окись углерода, попадая в организм, вступает в реакцию с гемоглобином крови, который является передатчиком кислорода, и образует стойкое соединение (метгемоглобин), в результате чего снижается доставка кислорода к тканям. Высокая токсичность метанола объясняется его окислением в организме с последующим расщеплением в формальдегид и муравьиную кислоту. Вместе с тем многие ядовитые вещества в результате реакций, протекающих в организме, превращаются в менее токсичные или вообще нетоксичные продукты. Так, например, довольно ядовитые соединения двухвалентного железа окисляются в организме в нетоксичные трехвалентные соединения. [c.41]
Элементы железо, рутений, осмнй. Строение электронных оболочек их атомов. Валентность железа в соединениях. Положение железа в ряду напряжений и его отношение к различным окислителям. Окислы железа и их химические свойства. Оксидирование железа как один из методов борьбы с коррозией. Гидроокиси железа. Соли двухвалентного и трехвалентного железа. Их окислительно восстановительные свойства. Комплексные соединения железа. [c.321]
Окисление сульфидов в сульфаты также сопровождается выделением SO2 и SO3. При прокаливании происходит также окисление соединений двухвалентного железа в соединения трехвалентного [c.17]
Соединения железа. В химических соединениях железо бывает главным образом двух- и трехвалентно. Соединения двухвалентного железа называют закисными, а трехвалентного — окиснымн. К соединениям двухвалентного железа относятся РеО — закись железа — порошок черного цвета Ре(ОН)а — гидроокись железа (И) — веш,есгво белого цвета, мгновенно окисляющееся на воздухе и нри- [c.175]
Двухвалентное железо надо предварительно окислить, трехвалентное железо надо связать в комплекс, лучше всего фторидом натрия, так как образующееся тогда с железом нерастворимое соединение бесцветно и не мешает титрованию. Медь сильно мешает определению ее надо выделить или в виде металла (алюминием, цинком), или в виде иодида меди (I) (добавлением иодида калия). [c.412]
Аналогично в пятой группе элементов известны химически устойчивые молекулы галогенидов ванадия, ниобия и тантала трех формул МХ5, МХ4 и МХз [406]. Для галогенидов группы марганца, железа, кобальта и никеля можно ориентироваться только на равновесие между двух- и трехвалентными соединениями, которые оба являются химически устойчивыми [61]. [c.254]
Двухвалентное железо, дающее соединение зеленого цвета, обычно не мешает, так как окисляется до трехвалентного еще при разложении навески. [c.222]
Железо образует два ряда соединений, соответствующих двум окислам закиси железа FeO, где железо двухвалентно, и окиси железа FegOg, где железо трехвалентно. Известны также соединения шестивалентного железа. [c.304]
Валентность. Уран в соединениях может быть трех-, четырех- пяти- и шестивалентным. Соединения трехвалентного урана аналогичны соединениям железа (П1), соединения четырех- и пятивалентного урана неустойчивы, а шестивалентный уран образует уранаты, диуранаты и соли уранила. Ион трехвалентного урана —розового или пурпурного цвета. На воздухе он быстро окисляется. Ион четырехвалентного урана —зеленого цвета. [c.402]
Очистка газа от сероводорода в процессе Сальфинт основан на окислении НгЗ в серу в жидкой среде, содержащей трехвалентное соединение железа хелатного типа. [c.151]
Эта реакция при 50—55° протекает стехиометрически. В качестве индикатора используют сульфосалициловую кислоту, которая з сильяокислой среде образует с ионом трехвалентного железа растворимое соединение лилово-красного цвета. В точке эквивалентности окраска исчезает, поскольку комплексон извлекает железо из его соединения с сульфосалициловой кислотой. [c.198]
Для галлия и индия валентность 3 наиболее характерна, тал-лий же дает более устойчивые соединения в одновалентной форме. В зависимости от той или иной валентности проявляете сходство этих элементов с другими элементами. Так, индий В( двухвалентной (сравнительно мало устойчивой форме) сходен с цинком, в трехвалентной — с алюминием и железом. Трехвалентный таллий также сходен с алюминием и железом, но одновалентный проявляет много общего с элементами обеих подгрупп [c.392]
При действии на гемоглобин концентрированной уксусной кислоты в присутствии Na l гем отщепляется в виде его окисленной формы — г е м и н а. Это соединение отличается от гема тем, что в гемине железо трехвалентно и связано с атомом хлора [c.64]
Написание формул ионов. Ионы несут положительные или отрицательные заряды. Валентность элемента, образующего данный ион, определяют числом электрических зарядов этого иона. Например, в соединении Fe L ионы железа двухзарядные, следовательно, железо в этом соединении двухвалентное. В Fed, ионы железа трехзарядные, т. е. железо трехвалентное. [c.27]
Колориметрический метод с сульфосалициловой кислотой основан на образовании ионами железа комплексных соединений с сульфосалициловой кислотой. Для осаждения применяют 10%-ный раствор сульфосалициловой кислоты или насыщенный водный раствор сульфосалицилата натрия. В слабокислой среде сульфосалициловая кислота образует с трехвалентным железом комплексное соединение красного цвета. В слабоаммиачной среде сульфосалициловая кислота реагирует как с трех-, так и с двухвалентным железом, образуя соединение желтого цвета. По двум определениям в слабокислой и слабощелочной среде можно раздельно рассчитать содержание ре + и Ре +. [c.198]
Для удаления фосфатов из раствора кремнефтористоводородной кислоты в реактор добавляют соль трехвалентного железа при соотношении [Ре] [Р04] = 1. Эта операция осуществляется перед добавлением гидроксида алюминия. В качестве трехвалентного железа используется соединение типа (Pep2)2Sip6, которое получают взаимодействием железа с h3Sip6 - [c.99]
Таким же путем можно установить валентность элементов, например, из следующего ряда кислородных соединений НагО, СаО, РегОз, СО2, N2O5, SO3, МпаО/, OSO4, в которых натрий — одновалентен, кальций — двухвалентен, железо — трехвалентно, углерод — четырехвалентен, азот — пятивалентен, сера — щестивалент-на, марганец — семивалентен, осмий — восьмивалентен. [c.34]
Например, зная, что хлор — одновалентен (по НС1), можно, исходя из формул следующих соединений КС1, ВаСЬ, РеС1з, U, P I5, заключить, что калий — одновалентен, барий — двухвалентен, железо — трехвалентно, углерод — четырехвалентен, фосфор — пятивалентен. [c.34]
Прочность внутрикомплексных соединений характеризуется константой нестойкости или отрицательным логарифмом этой константы рК=—1 Л . Более высокое значение рК характеризует высокую устойчивость комплексо-ната. Так, рК для ЭДТАцетатов кальция, магния, железа двухвалентного, железа трехвалентного, меди, цинка равны соответственно 10,96 8,69 14,33 25,1 18,6 16,1. [c.176]
При окраске раствора соединениями трехвалентного железа аликвотную часть фильтрата (5—25 мл) в зависимости от содержания фосфора помещают в фарфоровую чашечку, выпаривают досуха и обрабатывают 2—3 раза концентрированной азотной кислотой (чтобы перевести осадок в азотнокислые соли). Осадок растворяют 20—25 мл горячей воды, раствор переносят в стакан на 50 мл, нагревают до кипения, снИхМают с плитки и прибавляют на кончике ножа порошок металлического алюминия, который восстанавливает железо трехвалентное в железо двухвалентное и обесцвечивает раствор. Раствор разбавляют водой, нейтрализуют аммиаком (25 /о) до появления мути и затем 2—3 каплями раствора НЫОз (уд. вес 1,4) растворяют ]муть. [c.77]
По данным Всемирной организации здравоохранения (Jaag, 1969), после биологической очистки сточных вод из них извлекается лишь 20—40% фосфора, а больше половины поступает на сброс. Фосфор рекомендуется осуждать катионами трехвалентного железа, трехвалентного алюминия или двухвалентного кальция. Каждое из этих соединений осаждает фосфор в виде нерастворимых в воде солей. Используя 20—30 мг трехвалентно-го железа на 1 л воды, можно удалк гь из сточных вод 95% общего фосфора при pH 7,5. Азот удаляется из сточных вод при их биологической очистке. При снижении БПКб до 15 мг. Ог/л содержание азота в сточных водах можно уменьшить до 3 мг/л, а фосфора — до 0,5 мг/л. [c.78]
На основе этой закономерности с помощью веществ, образующих буферные системы (системы, поддерживающие постоянство величины pH), возможно вызывать осаждение одних катионов в виде гидроокисей и удерживать другие в растворе. Такое осаждение при контролируемой величине pH раствора достигается, например, взбалтыванием растворов с супензией карбоната бария, pH которой равен приблизительно 7,25. При этом железо (трехвалентное) может быть отделено от марганца. При прибавлении органического соединения—пиридина gHjN к слабокислому раствору устанавливается рН=6,5. Это также дает возможность отделять Ре +, Сг +, AF+ отМп +, Со +, Ni . Применяются еще суспензии окиси цинка (pH = 5—6), окиси магния (pH=8) и др., а также ряд хорошо растворимых веществ. [c.67]
chem21.info
Железо двухвалентное - Справочник химика 21
Так, например, реакцию восстановления трехвалентного железа двухвалентным оловом [c.288]В продуктах коррозии железа в морской воде находится феррит магния или кальция, образующийся при замещении ионов железа двухвалентными катионами магния и кальция. Образующийся феррит магния связывает отдельные продукты коррозии, но не предотвращает лущение чешуйчатой ржавчины. [c.81]
Опыт 13. Гидролиз солей железа (двухвалентного и трехвалентного) [c.244]В УНИХИМе разработан и испытан в опытно-заводском масштабе метод получения сульфата железа(III) из железного купороса — отхода производства диоксида титана следующего состава (в %) водорастворимое железо (в пересчете на ГегОз) 32—37, железо двухвалентное (в пересчете на РеО) 0,2—1,5, свободная серная кислота 0,1 —1,5 и нерастворимый остаток 15—20. Способ сострит в окислении кислородом воздуха при повышенных температурах сульфата железа (II) в аппаратах кипящего слоя [61]. Из сульфата железа (II) и воды при массовом соотношении 1 1 при 75—85 °С готовят суспензию в растворных баках, снабженных мешалками и змеевиками-подогревателями. При этих условиях гептагидрат железного купороса частично растворяется, образуя насыщенный раствор, а частично дегидратирует по реакции [c.108]
Железо двухвалентное 0—0,5 5—30 30 100—98 Легкие полосы Полублестящие Темно-серые [c.248]
С другой стороны, металлический висмут окисляется при определенных условиях растворами трехвалентного железа, двухвалентной меди, иодом, азотной кислотой и др. Мелкораздробленный металлический висмут сравнительно легко окисляется кислородом в присутствии влаги при хранении на воздухе, а также при высушивании при 100°. [c.259]
В геме железо двухвалентное. Комплекс, содержащий трехзарядный ион, называется гемином. Гем в составе белка гемоглобина обладает свойством обратимо присоединять молекулу кислорода. Именно благодаря наличию в эритроцитах гемоглобина кровь в легочных альвеолах насыщается кислородом, который затем доставляется ею ко всем клеткам и используется при выработке энергии для нужд их жизнедеятельности. Кроме гемоглобина, гем входит в состав цитохромов — важнейших ферментов животного и растительного мира, управляющих окислительными процессами в живой клетке. [c.447]
Катионы металлов двухвалентная медь, трехвалентное железо, двухвалентные марганец и кобальт. [c.336]
Бихромат-ион, хромовый ангидрид (хромат-ион каталитически не действует), добавление в качестве катализаторов катионов двухвалентного марганца, двухвалентной меди, трехвалентного железа, двухвалентного кобальта и двухвалентного никеля, показывает уменьшение влияния в приведенной последовательности наименьшие концентрации, дающие заметный каталитический эффект [c.81]
Определению не мешают ионы ацетата, алюминия, аммония, бромида, кальция, хлорида, трехвалентного хрома, кобальта, двухвалентной меди, бихромата, фторида, трехвалентного железа, двухвалентного свинца, двухвалентного марганца, молибдата, никеля, оксалата, перхлората, перманганата, калия, серебра, натрия, сульфата, ванадата и цинка. Мешают ионы силиката, арсената, арсенита, германата и нитрита их следует удалять перед первой экстракцией. Допустимо присутствие не более 200 мкг мл нитрата и 20 мкг мл вольфрамата. [c.22]
Кислород, выделенный в кровяных капиллярах, диффундирует в ткани, где он используется для реакций окисления. В оксигемоглобине железо двухвалентно, так же как и в гемоглобине. Только природный гемоглобин может связывать кислород подобным образом ни метгемоглобин, ни гемохромоген не обладают этим свойством. [c.454]
Из катионов в большей степени способствуют возникновению питтинга в присутствии агрессивных галоидных анионов окислительные металлические ионы трехвалентного железа, двухвалентной меди, двухвалентной ртути. Галоидные неокислительные соли таких катионов как А1, Са, M.g, хотя и вызывают питтинговую коррозию, но в меньшей мере, чем соли с окислительными катионами. [c.98]
В буферных растворах уксусной кислоты и ацетата натрия иодид-ионами осаждаются в присутствии комплексона только серебро и таллий. Остальные катионы, по-иному реагирующие с иодидом, как, например, трехвалентное железо, двухвалентная медь, свинец, висмут и т. д., связываются комплексоном в прочные, не реагирующие с иодидом комплексы. В отсутствие серебра можно определить одновалентный таллий в виде T1J [39]. [c.101]
Железа двухвалентного соли [c.358]
Железа двухвалентного соли — Взаимодействуют, окисляясь до солей трехвалентного железа [c.344]
В карбоксигемоглобине, так же как и в гемоглобине и оксигемоглобине, железо двухвалентно. [c.66]
Вне организма гемоглобин быстро превращается в метгемогло-б и н, который отличается от оксигемоглобина более прочной связью с кислородом и при расщеплении образует наряду с глобином г е м а-т и н у последнего при атоме железа имеется одна гидроксильная группа. В гемоглобине железо двухвалентно, в метгемоглобине и тематике — трехвалентно. [c.974]
Цепи могут обрываться также при взаимодействии радикалов с ингибиторами. В качестве ингибиторов могут использоваться малоактивные стабильные свободные радикалы, например дифе-нилпикрилгидразил, Ы-оксидные радикалы, которые сами не инициируют полимеризацию, но рекомбинируют или диспропорциони-руют с растущими радикалами. Ингибиторами могут служить также вещества, молекулы которых, взаимодействуя с активными радикалами, насыщают их свободные валентности, а сами превращаются в малоактивные радикалы. К числу последних относятся хиноны (например, бензохинон, дурохинон), ароматические ди- и тринитросоединения (динитробензол, тринитробензол), молекулярный кислород, сера и др. Ингибиторами могут быть также соединения металлов переменной валентности (соли трехвалентного железа, двухвалентной меди и др.), которые обрывают растущие цепи за счет окислительно-восстановительных реакций. Часто ингибиторы вводят в мономер для предотвращения их преждевременной полимеризации. Поэтому перед полимеризацией каждый мономер необходимо тщательно очищать от примесей и добавленного ингибитора. [c.11]
Салицилгидроксамовая кислота применяется в качестве аналитического реагента при определении урана, ванадия, молибдена, железа двухвалентного и кадмия [1, 2]. [c.24]
Перманганатная окисляемость — обобщенный показатель, характеризующий содержание в воде легкоокисляемых органических и некоторых неорганических соединений (нитриты, сильфиты, железо двухвалентное). Под окисляемостью понимают количество кислорода, эквивалентное расходу перманганата калия. [c.34]
Трехвалентное железо, двухвалентная ртуть, серебро, висмут, трехвалентная сурьма, свинец, трехвалентное золото, хлороплати-наты и метаванадаты мешают определению, так как выпадают в осадок. Влияния их устраняют соответствующим разбавлением. [c.183]
Максимумы светопоглощения экстрактов в изобутаноле находятся при 625 и 725 ммк. Оптимальные пределы концентрации фосфора составляют 0,2—1,5 мкг1мл. Определению не мешают ионы ацетата, бромида, карбоната, хлорида, цитрата, бихромата, фторида, йодата, нитрата, нитрита, оксалата, перманганата, сульфата, аммония, алюминия, бария, трехвалентного висмута, кадмия, кальция, трехвалентного хрома, двухвалентного кобальта, двухвалентной меди, двухвалентного железа, трехвалентного железа, двухвалентного свинца, лития, магния, двухвалентного марганца, двухвалентного никеля, калия, серебра, натрия, четырехвалентного тория, уранила и цинка. Концентрация ионов трехвалентного мышьяка, йодида и роданида не должна быть выше 50 мкг/мл, а концентрация силиката или четырехвалентного олова — выше 25 мкг/мл. Опре- [c.15]
Метод почти специфичен для селена. Четырехвалентный теллур не реагирует. Пятивалентный ванадий, трехвалентное железо, двухвалентная медь и другие окислители мешают определению, давая окрашенные продукты с реагентом. Ост и Гиллис [19] применяли фторид для маскировки железа и оксалат для маскировки меди. Чжэн [6, 7] маскировал все мешающие ионы, за исключением пятивалентного ванадия, этилендиаминтетрауксусной кислотой. При экстрагировании пиазселенола все окрашенные ионы остаются в водной фазе. Вещества, которые восстанавливают или связывают в комплекс четырехвалентный селен, мешают определению, например ионы двухвалентного олова и йодида, а также аскорбиновой кислоты. [c.385]
Часто имеет большое значение качественное или количественное определение в растворах перекиси водорода различных небольших добавок, например стабилизаторов, или примесей, особенно каталитически действующих ионов металлов. На стр. 467 указано, что при этом можно использовать полярографические методы [97], например для открытия присутствия таких каталитически действующих ионов, как окисного железа, двухвалентной меди или свинца, или же для установления присутствия стагшатного стабилизатора. Вместо этого можно поступить еще следующим образом выпаривают и разлагают достаточно большую пробу перекнси в таких условиях, чтобы получающийся остаток был загрязнен лишь минимальным количеством материала стенок сосуда, и то только известного состава, после чего остаток исследуют спектроскопически. Если в процессе выпаривания раствора возможно разложение пробы перекиси, необходимо принимать меры против уноса в брызгах заметных количеств растворенных веществ, возникающих при разложении в противном случае эти вещества будут потеряны для последующего анализа остатка. Совершенно очевидно, что, если даже сосуд сделан из столь инертных материалов, как алюминий высокой чистоты или боросиликатное стекло, все же небольшое попадание этих веществ в раствор неизбежно. Этот вопрос обсуждается в литературе [46]. [c.469]
Сравнивая состав двух сернокислых солей железа РеЗО и Ре2(304)з, мы должны первую, в которой железо двухвалентно, назвать закисной, а вторую, с трехвалентны1и железом — окисной. [c.13]
Валентность радикала связана с валентиос ью железа Присутствие металла в кислотном остатке понижает ва лентность кислотного остатка, при чем это понижение зависит от валентностн металла. В желтой соли железе двухвалентно, в красной соли трехвалентно. Поэтому остаток [Ре(СК)в], который без железа был бы шести валентен (СК ),,, в желтой соли — четырехвалентен (6 — 2) в красной—трехвалентен (6 — 3). [c.242]
Принцип метсда. Трехвалентный кобальт, связанный комплексоном в комплекс, можно определить титрованием раствором сульфата хрома (II). Определение нужно проводить при нагревании и следует соблюдать все условия, применяемые при титровании в атмосфере инертного газа. Сульфатом хрома (П) восстанавливаются и другие катионы, например трехвалентное железо, двухвалентная медь и т. д. Для практического применения метод имеет небольшое значение. [c.140]
Если бы мы опирались при характеристике железа только на соединения, в которых железо двухвалентно, мы должны были бы отнести железо к числу рчень резко выраженных-металлов и констатировать ближайшее сходство железа с магнием. Перейдя в трехвалентное состояние железо с утратой еще одного валентного электрона утрачивает и резкометаллический характер и приближается по свойствам уже к элементу, переходному от металлов к неметаллам — алюминию. Наконец, в шестивалентном состоянии железо утрачивает все черты металла и выступает как резко выраженный неметалл в этом состоянии Ре ближе всего напоминает шестивалентную серу. [c.502]
Биологическая химия Изд.3 (1998) -- [ c.503 , c.584 ]Биохимия (2004) -- [ c.50 , c.411 ]
Основы аналитической химии Часть 2 (1965) -- [ c.0 ]
Практическое руководство по неорганическому анализу (1966) -- [ c.0 , c.987 , c.1058 ]
Аналитическая химия (1963) -- [ c.0 ]
Курс аналитической химии Издание 5 (1982) -- [ c.137 , c.138 , c.161 ]
Курс аналитической химии Издание 5 (1981) -- [ c.206 ]
Курс аналитической химии (1964) -- [ c.0 ]
Курс аналитической химии Издание 2 (1968) -- [ c.141 ]
Курс аналитической химии Издание 4 (1977) -- [ c.142 ]
Курс качественного химического полумикроанализа (1950) -- [ c.209 ]
Практическое руководство по неорганическому анализу (1960) -- [ c.903 , c.968 ]
Основы аналитической химии Издание 3 (1971) -- [ c.0 ]
Основы аналитической химии Кн 2 (1965) -- [ c.0 ]
Основы общей химии Том 3 (1970) -- [ c.116 , c.150 ]
Практикум по общей химии Издание 2 1954 (1954) -- [ c.296 ]
Практикум по общей химии Издание 3 (1957) -- [ c.303 ]
Практикум по общей химии Издание 4 (1960) -- [ c.303 ]
Практикум по общей химии Издание 5 (1964) -- [ c.326 ]
Инженерная лимнология (1987) -- [ c.197 ]
chem21.info
Содержание - трехвалентное железо - Большая Энциклопедия Нефти и Газа, статья, страница 1
Содержание - трехвалентное железо
Cтраница 1
Содержание трехвалентного железа в пересчете на РегОз вычисляют по формуле, приведенной в разд. [1]
Определение содержания трехвалентного железа производится объемным комплексонометрическим методом ( см. стр. [2]
Для определения содержания трехвалентного железа в растворе используется ряд реакций. [3]
Характерна зависимость содержания трехвалентного железа в отложениях на металлической трубке, отнесенного к единице времени и поверхности от температуры стенки для каждой длительности отбора. Что касается других компонентов, то их содержание в отложениях на кварцевой и металлической трубках относительно близко друг к другу. [4]
Практически было показано, что содержание трехвалентного железа в окалине изменяется в широких пределах. [5]
В том и другом случае параллельно проводится определение содержания трехвалентного железа и общее содержание железа в водах после окисления всех форм железа до окисного. [6]
По-видимому, отмеченная аномалия связана с резким возрастанием содержания трехвалентного железа при уменьшении кислотности расплавов. [7]
Для получения растворов с заданным количественным соотношением Fe / Fe3 необходимо определить содержание двух-и трехвалентного железа в полученных препаратах. [8]
Выразив в процентах результаты определений до и после восстановления и вычтя из второго результата первый, можно вычислить содержание трехвалентного железа в смеси. [9]
Хлорное железо находится в растворенном состоянии до тех пор, пока кислота имеет химическую активность. При содержании трехвалентного железа в растворе 0 3 - 0 4 % в результате нейтрализации кислоты породой образуется около 6000 - 8000 мг осадка на каждый литр закачиваемого в пласт кислотного раствора, что может вызвать закупорку каналов в пласте, только что вскрытых и расширенных в результате кислотной обработки. [10]
Для определения общего содержания железа к 100 мл анализируемой воды добавляют 5 мл НС1 ( 1: 1) и 0 5 г надсернокислого аммония ( Nh5) 2 S208i Раствор кипятят в течение 10 мин и после того как он остынет, определяют общее содержание железа радонидо-метрическим методом. Общее содержание железа подсчитывают по той же формуле, что и содержание трехвалентного железа. Вычитая из второго определения первое, находят количество двухвалентного железа в воде. [11]
В качестве зернистого фильтра применялись фильтры, заполненные песком, мраморной крошкой и антрацитом с диаметром зерен 1 0 - 1 2 мм. Адгезия оценивалась посредством коэффициента адгезии К & л, который равен отношению числа прилипших частиц, оставшихся после промывки фильтра, к общему числу частиц, задерживаемых фильтром. Значения коэффициента адгезии определяли двумя методами: аналитическим - по содержанию трехвалентного железа, количество которого пропорционально числу частиц, и по концентрации суспензии. [13]
Определяют обычно отдельно окисное железо и общее содержание железа. Для определения общего содержания двухвалентное железо предварительно окисляют до трехвалентного. Двухвалентное железо вычисляют по разности между общим содержанием железа и содержанием трехвалентного железа. [14]
Электропроводность магнетитовых анодов обусловлена переносом электронов между разновалентными ионами, находящимися в одном кристаллографическом положении. Увеличение содержания трехвалентного железа повышает коррозионную стойкость магнетита, но сильно снижает электропроводность. [15]
Страницы: 1 2
www.ngpedia.ru
Железо трехвалентное - Справочник химика 21
Восстановление растворами восстановителей. Самый широко распространенный прием был описан в гл. 20, посвященной перманганатометрическому определению железа. Трехвалентное железо восстанавливают избытком раствора дихлорида олова [c.436]Железо. Трехвалентное железо окисляет эриохром черный Т. В присутствии железа появляется темная красноватая окраска, которая в эквивалентной точке пе переходит в синюю. Для устранения влияния железа можно применить маскирующие вещества или осадителн (цианиды, триэтаноламин, диэтилдитиокарбаминат натрия и сульфиды). При маскировании цианидами железо надо предварительно восстановить до двухвалентного состояния, иначе образующийся феррицианидный комплекс железа разрушит индикатор (а ферроциапид пе мешает). Железо надо восстанавливать в слабокислои растворе. Из всех восстановителей для этой цели наиболее пригодна аскорбиновая кислота [698,1073]. Она восстанавливает железо быстро и количественно даже в щелочном растворе [698]. После восстановления железа раствор надо нейтрализовать аммиаком до неисчезающей мути, затем ввести K N, лучше в твердом виде. После добавления K N раствор стано- [c.78]
При окислении гем превращается в гематин (в котором железо трехвалентно), причем этот переход является обратимым. [c.974]Н2О, не отфильтровывая, растворяют добавлением ацетона, измеряют оптическую плотность красного раствора при 530 ммк [63]. Оптическая плотность не изменяется 3 часа. Растворы подчиняются закону Бера до концентрации не выше 20 ммк мл Мо. Не мешают кальций, магний, небольшие количества кадмия, никеля, цинка, железа, трехвалентного хрома. Мешают Мп, Си, Се, Т1, W. [c.227]
На первых установках этого типа применяли самую примитивную форму процесса сухой очистки. При этом варианте процесса полное удаление НаЗ достигается взаимодействием газа с гидратированной окисью железа, которая при этом превращается в сернистое железо (трехвалентное). Под действием атмосферного кислорода сернистое железо снова окисляется с образованием элементарной серы и окиси железа, которая в последующем -снова взаимодействует с дополнительным количеством НаЗ. Такой цикл может повторяться до тех пор, пока элементарная сера не покроет большую часть поверхности очистной массы и не заполнит значительную часть объема пор между частицами массы. После этого активность очистной массы снижается, а гидравлическое сопротивление слоя возрастает. Выделившуюся серу удаляют и окись железа можно снова использовать для очистки. [c.170]
Оксихинолин отличается от других оксихинолинов пространственным расположением гидроксильной группы по отношению к азоту кольца. В результате такого расположения ионы многих металлов образуют с 8-оксихинолинами нерастворимые клешнеобразные соединения. Такие металлы, как медь, цинк, кадмий, алюминий, висмут, уран, марганец, железо (трехвалентное) и никель, наряду с некоторыми другими, осаждаются в виде клешнеобразных соединений с 8-оксихинолином из его раствора, содержащего уксуснокислый натрий. Вследствие этого 8-оксихинолин является одним из наиболее ценных органических реагентов для определения металлических ионов. Это соединение известно также под названием оксина оно было предложено в качестве аналитического реактива Ханом [449] и Бергом [450]. Имеются хорошие обзоры работ с применением этого реагента [4506, 451]. [c.104]
Ионы Окислы Органиче- / ские соеди- 1 нения 1 Двухвалентное железо Трехвалентное железо Вода Окись углерода Нафталин Тригональная 27 [c.426]
Суммарная реакция, характеризующая возможность окисления железа трехвалентными ее ионами, опишется уравнением (85,1). Подсчитаем свободную энергию суммарной реакции. Последняя, как известно, равна сумме свободных энергий образования продуктов реакции за вычетом суммы свободных энергий образования исходных веществ. [c.50]
Собрать прибор для фильтрования под вакуумом по рис. 38. Получить один из осадков гидрата окиси железа трехвалентного, меди, цинка, алюминия, действуя на ра-46 [c.46]
При действии на гемоглобин кислот небелковая группа (гем) отщепляется и в присутствии солей переходит в г е-м и н, в котором Железо трехвалентное. [c.233]
На рис. 63, заимствованном из книги А. Ф. Уэллса , приведены структуры берлинской зелени, где все атомы железа трехвалентны, берлинской лазури и ферроцианида железа (П) и калия. [c.505]
В полученном описанным выше способом растворе железо трехвалентное его надо восстановить до двухвалентного. Это может быть достигнуто разными методами для восстановления применяют цинк, хлорид олова, амальгамы. [c.261]
При титровании соли окиси железа трехвалентным титаном окисное железо снова восстанавливается до закисного, а -трехвалентный титан окисляется [c.378]
Как уже говорилось в гл. 5 и 6, электронные свойства и реакционная способность катализатора могут быть изменены путем введения определенных примесей в кристаллическую решетку основного вещества. Марголис и сотр. [40] изменяли работу выхода электрона путем введения в закись меди добавок ионов трехвалентного железа, трехвалентного хрома, лития, [c.327]
Соль железосинеродистой кислоты IЬ[Fe( N)5], в которой железо трехвалентно. Не смешивайте этот реактив с K4[Fe( N)5l, применяе. ым для открытия Fe [c.302]
Практически полностью выделяют германий из растворов соосаждением с гидроокисями тяжелых металлов — железа, меди, никеля и т. п. или алюминия [34, 37]. Соосаждение германия происходит в основном за счет образования нерастворимых германатов [37, 38]. Чаще всего пользуются соосаждением германия с железом. Для полного соосаждения германия отношение Ре Ое в растворе должно быть порядка 25—100 [36, 38]. При наличии в растворе магния достаточно только 10—15-кратного количества железа [39]. При соосаждении с железом (трехвалентным) или алюминием pH раствора доводится до 4,5—6, при соосаждении с медью или никелем —до 6—7,5 [34]. По данным [39], для полного соосаждения германия с железом требуется более высокий pH, а именно 7 и выше. Регулировать pH можно, добавляя соду, аммиак, окись цинка. Хорошие результаты получаются при нейтрализации раствора окисью магния (вследствие нерастворимости германата магния). Для получения более богатых германиевых продуктов рекомендуется осаждать в две стадии сначала при pH 4—5 осаждают часть гидроокисей, получая богатый германиевый осадок затем при более высоком pH осаждают полностью, получая бедный германием материал, возвращаемый на переработку [9]. [c.362]
OsOj, как это легко установить, натрий одновалентен, кальций двухвалентен, железо трехвалентно, углерод четырехвалентен, фосфор пятивалентен, сера шестивалентна, марганец семивалентен, осмий восьмивалентен. Валентность выше 8 не обнаружена. [c.26]
Открытие азота. Для открытия азота небольшое количество органического вещества сильно прокаливают с металлическим калием или натрием. При этом калий (или натрий) соединяется с частью углерода и азота органического вещества, образуя цианистый калий K N (или цианистый натрий Na N), Полученный плав растворяют в воде н прибавляют к нему раствор соли двухвалентного железа, например железного купороса РеЗО -УН О, и раствор хлорного железа Fe lg, в котором железо трехвалентно. После подкисления выпадает темно-синий осадок берлинской лазури. [c.27]
В состав макромолекулы гемоглобина входят четыре молекулы гсма (и, следовательно, четыре атома железа). При воздействии на гемоглобин уксусной кислоты (в присутствии хлористого натрия) гсм прсвра1Г1,ается в окисленную форму — гемин. В молекуле гемина железо трехвалентно (третья валентная связь соединяет железо с атомом хлора). [c.44]
Выбор того или иного электрода и потенциала для титрования зависит от состава титруемого раствора анодный метод с платиновым электродом особенно пригоден в присутствии различных примесей, так как при указанном выше потенциале обычные элементы (железо трехвалентное, ионы водорода, кислород и др.) не будут давать диффузионного тока. При всех вариантах титрования мешают вещества, осаждающиеся оксихинолином в данных условиях (в кислой среде в присутствии иодида), в первую очередь кадмий и медь. Свинец, который также может мешать, осаждают в виде сульфата в сильнокислом растворе (азотная кислота 2,5 М) осадок отфильтровывать нет надобности, титрование проводят непосредственно в присутствии осадка сульфата свинца. При титровании следует избегать присутствия больше чем 0,1 н. хлорид-ионов, так как хлорид увеличивает растворимость осадка иодокси-хинолята висмута. Описанный метод позволяет определять 15 мг (и больше) висмута в 30 мл раствора, причем средняя ошибка не превышает 1% (судя по таблицам, приведенным в статье ). Определение меньших количеств висмута ограничено растворимостью осадка. [c.187]
Железо образует два ряда соединений, соответствующих двум окислам закиси железа FeO, где железо двухвалентно, и окиси железа FegOg, где железо трехвалентно. Известны также соединения шестивалентного железа. [c.304]
Максимумы светопоглощения экстрактов в изобутаноле находятся при 625 и 725 ммк. Оптимальные пределы концентрации фосфора составляют 0,2—1,5 мкг1мл. Определению не мешают ионы ацетата, бромида, карбоната, хлорида, цитрата, бихромата, фторида, йодата, нитрата, нитрита, оксалата, перманганата, сульфата, аммония, алюминия, бария, трехвалентного висмута, кадмия, кальция, трехвалентного хрома, двухвалентного кобальта, двухвалентной меди, двухвалентного железа, трехвалентного железа, двухвалентного свинца, лития, магния, двухвалентного марганца, двухвалентного никеля, калия, серебра, натрия, четырехвалентного тория, уранила и цинка. Концентрация ионов трехвалентного мышьяка, йодида и роданида не должна быть выше 50 мкг/мл, а концентрация силиката или четырехвалентного олова — выше 25 мкг/мл. Опре- [c.15]
Сульфат бария благодаря его крайне низкой растворимости используют для аналитического определения как ионов 80 , так и ионов Ва". При этом необходимо учитывать, что Ва804 может увлекать с собой в значительных количествах и другие вещества, находящиеся в растворе, особенно многовалентные ионы, например сульфаты трехвалентного железа, трехвалентного хрома и алюминия. До сих пор еще не установлено, обусловливается ли это явление адсорбцией или оно связано с образованием твердых растворов.. [c.318]
Для галлия и индия валентность 3 наиболее характерна, тал-лий же дает более устойчивые соединения в одновалентной форме. В зависимости от той или иной валентности проявляете сходство этих элементов с другими элементами. Так, индий В( двухвалентной (сравнительно мало устойчивой форме) сходен с цинком, в трехвалентной — с алюминием и железом. Трехвалентный таллий также сходен с алюминием и железом, но одновалентный проявляет много общего с элементами обеих подгрупп [c.392]
В 52 настоящей главы в сноске 56 мы упомянули об электродиализе слюдистых минералов как об особенно эффективном методе для полного удаления оснований из слоистых силикатов. Рой исследовал разложение биотита и джефферизита в специальной (фирмы Льюсит) камере для электродиализа (см. А. III, 51 и 52), при помощи которой он мог удалить 80—90% уходящих катионов. Остаточная кремнеземистая псевдоморфоза была изотропна, имела показатель светопреломления 1,50 и рентгенограмму, на которой период идентичности совпадал с периодом идентичности исходной слюды. Тот же процесс, однако, протекал совершенно иначе в флогопите и в щелочных слюдах мусковит отдавал только небольшое количество железа и все свои щелочи, но далее не разлагался. Лепидолит терял щелочи особенно быстро. По степени выщелачиваемости катионы можно расположить в следующий ряд щелочи— двувалентное железо — трехвалентное железо — магний — алюминий — кремний. [c.673]
Изменение валентного состояния элемента нри работе с ультра-малыми концентрациями в некоторых случаях происходит даже в исходном растворе, до экстракции. Это иногда наблюдается в растворах, содержащих радиоактивные изотопы без носителя. Если не учитывать возможности изменения валентного состояния таких растворов при хранении, то результаты экстракции могут оказаться неожиданными. Показано, например, что под действием радиоизлучения и значительная часть трехвалентной сурьмы при продолжительном стоянии в солянокислом растворе переходит в пятивалентную [484]. Такие изменения могут иметь место преимущественно с теми состояниями окисления, которые вообще склонны переходить в другое валентное состояние,— двухвалентным кобальтом, двухвалентным железом, трехвалентным таллием и т. п. [c.164]
При действии на гемоглобин концентрированной уксусной кислоты в присутствии Na l гем отщепляется в виде его окисленной формы — г е м и н а. Это соединение отличается от гема тем, что в гемине железо трехвалентно и связано с атомом хлора [c.64]
Соль железосинеродистоводородной кислоты Нз[Ре(СМ),], в которой железо трехвалентно. Не смешивайте этот реактив с ферроцианидом калия К4[Ре(СМ)в], применяющимся для открытия Ре " [c.310]
Написание формул ионов. Ионы несут положительные или отрицательные заряды. Валентность элемента, образующего данный ион, определяют числом электрических зарядов этого иона. Например, в соединении Fe L ионы железа двухзарядные, следовательно, железо в этом соединении двухвалентное. В Fed, ионы железа трехзарядные, т. е. железо трехвалентное. [c.27]
Применение. Соли редкоземельных металлов применяются в технике пока ограниченно, так как они сравнительно мало изучены. В аналитической химии применяют лантан азотнокислый — в качестве реактива на ацетаты в капельном анализе и для гравиметрического определения фтора иттрий азотнокислый — для титриметрического определения фтора церий сернокислый — в цери-метрии для оксидиметрического определения двухвалентного железа, трехвалентной сурьмы и многих других. [c.32]
Курс аналитической химии. Кн.1 (1968) -- [ c.0 ]Биологическая химия Изд.3 (1998) -- [ c.503 , c.584 , c.632 ]
Основы аналитической химии Часть 2 (1965) -- [ c.0 ]
Практическое руководство по неорганическому анализу (1966) -- [ c.0 ]
Биотехнология (1988) -- [ c.192 , c.194 ]
Курс аналитической химии Книга 1 1964 (1964) -- [ c.0 ]
Аналитическая химия (1963) -- [ c.0 ]
Учебник общей химии 1963 (0) -- [ c.408 ]
Курс аналитической химии Издание 3 (1969) -- [ c.0 ]
Курс аналитической химии Издание 5 (1982) -- [ c.139 , c.279 ]
Курс аналитической химии Издание 5 (1981) -- [ c.206 ]
Курс аналитической химии (1964) -- [ c.0 ]
Курс аналитической химии Издание 2 (1968) -- [ c.139 ]
Курс аналитической химии Издание 4 (1977) -- [ c.140 ]
Курс качественного химического полумикроанализа (1950) -- [ c.207 ]
Практическое руководство по неорганическому анализу (1960) -- [ c.0 , c.399 , c.405 , c.910 ]
Основы аналитической химии Издание 3 (1971) -- [ c.0 ]
Основы аналитической химии Кн 2 (1965) -- [ c.0 ]
Основы общей химии Том 3 (1970) -- [ c.117 , c.162 ]
Практикум по общей химии Издание 2 1954 (1954) -- [ c.293 , c.297 ]
Практикум по общей химии Издание 3 (1957) -- [ c.300 , c.304 ]
Практикум по общей химии Издание 4 (1960) -- [ c.300 , c.304 ]
Практикум по общей химии Издание 5 (1964) -- [ c.323 , c.326 ]
Биотехнология - принципы и применение (1988) -- [ c.192 , c.194 ]
Инженерная лимнология (1987) -- [ c.197 ]
chem21.info