ТЕМА: ПАТОФИЗИОЛОГИЯ ГЕМОСТАЗА. ГЕМОРРАГИЧЕСКИЕ СОСТОЯНИЯ. ДВС - СИНДРОМ. Двс синдром патофизиология
ДВС-синдром: понятие, причины, стадии развития, морфологическая харак¬теристика, исходы.
Синдром диссеминированного внутрисосудистого свертывания крови (ДВС-синдром) характеризуется образованием множественных тромбов в сосудах микроциркуляторного русла различных органов и тканей вследствие активации факторов свертывания крови и развивающимся из-за этого их дефицитом с последующим усилением фибринолиза и развитием многочисленных кровоизлияний. Наиболее часто ДВС-синдром развивается при шоке (травматическом, анафилактическом, геморрагическом, кардиальном), переливании несовместимой крови, злокачественных опухолях, травмах и операциях, тяжелой интоксикации и инфекции, в акушерской патологии (преждевременная отслойка плаценты, эмболия околоплодными водами), при трансплантации органов.
Стадии ДВС-синдрома:
1-я стадия — гиперкоагуляции и тромбообразования — отличается внутрисосудистой агрегацией форменных элементов крови, диссеминированным свертыванием крови с формированием множественных тромбов в микрососудах различных органов и тканей. Кратковременная, до 8—10 мин, клинически может проявляться шоком.
2-я стадия — нарастающая коагулопатия потребления — характеризуется значительным понижением содержания тромбоцитов и фибриногена, израсходованных на образование тромбов. При этом происходит переход гиперкоагуляции на гипокоагуляцию. Удаление активных факторов свертывания из кровотока происходит и за счет фагоцитов, в связи с чем наличие фибрина в цитоплазме макрофагов и нейтрофилов служит признаком этой стадии.
3-я стадия — глубокой гипокоагуляции и активации фибринолиза — приводит к лизису образовавшихся ранее микротромбов и часто к повреждению циркулирующих в крови факторов свертывания. Развивающаяся гиперплазминемия приводит к появлению легко растворимых фибринсодержащих комплексов, продуктов деградации фибрина, причем мономер фибрина теряет способность к полимеризации. Вследствие этих изменений на 3-й стадии, развивающейся обычно через 2—8 ч от начала ДВС-синдрома, отмечается полная несвертываемость крови, а в связи с этим — выраженные кровотечения и кровоизлияния.
4-я стадия — восстановительная — отличается дистрофическими, некротическими и геморрагическими поражениями органов и тканей.
В зависимости от распространенности выделяют генерализованный и местный варианты ДВС-синдрома, а по продолжительности — острую (от нескольких часов до суток), подострую (от нескольких дней до недели) и хроническую (несколько недель и даже месяцев) формы.
Острая форма — при шоке (выраженной интоксикации, сепсисе, тяжелых травмах, ожоговой болезни), приводящая к генерализованному некротическому и геморрагическому поражению органов и тканей.
Подострое течение возникает при меньшей выраженности перечисленных выше этиологических факторов, а также в ряде случаев может осложнять течение поздних лейкозов, злокачественных опухолей.
Хроническая форма наблюдается при злокачественных новообразованиях, хронических лейкозах, аутоиммунных и ревматических заболеваниях, длительной интоксикации.
Морфология ДВС-синдрома.
Основные изменения — наличие в микроциркуляторном русле множественных микротромбов — фибриновые тромбы (состоящие из фибрина с отдельными эритроцитами), гиалиновые, белые (лейкоцитарные), красные (эритроцитарные). Отмечаются явления стаза в капиллярах и венулах, а также кровоизлияния, дистрофические и некротические изменения в различных органах и тканях.
В легких отмечается серозно-геморрагический отек, фибриновые и гиалиновые тромбы, сладжирование и агглютинация эритроцитов, множественные кровоизлияния.
В почках развивается дистрофия эпителия проксимальных и дистальных извитых канальцев, некроз клеток, тубулорексис, что является проявлением некротического нефроза (острой почечной недостаточности).
В печени дистрофические и некротические изменения гепатоцитов вплоть до центролобулярных некрозов могут сопровождаться фибриновыми тромбами в центральных венах, а также тяжами и нитями фибрина, свободно лежащими в синусоидах.
Поджелудочная железа, в которой отмечаются явления отека, кровоизлияния, микротромбы, а в тяжелых случаях — панкреонекроз.
В ткани селезенки помимо мелких кровоизлияний в паренхиму и под капсулу органа в мелких артериях и венах отмечаются гиалиновые и фибриновые тромбы, а в синусоидах — тяжи и нити фибрина.
причины, стадии, патогенез, симптомы, лечение
ДВС-синдром также называют синдромом диссеминированного внутрисосудистого свертывания. Это не отдельная патология или нозологическая единица. Он представляет собой сложный процесс, состоящий из нескольких этапов, во время которых в просвете кровеносных сосудов отмечается повышенное тромбообразование. Это достаточно распространенная ситуация. Чаще других с ней сталкиваются врачи хирургического профиля, а также педиатры. Лечение ДВС-синдрома крайне сложное, требующее ранней диагностики процесса.
Причины ДВС-синдрома
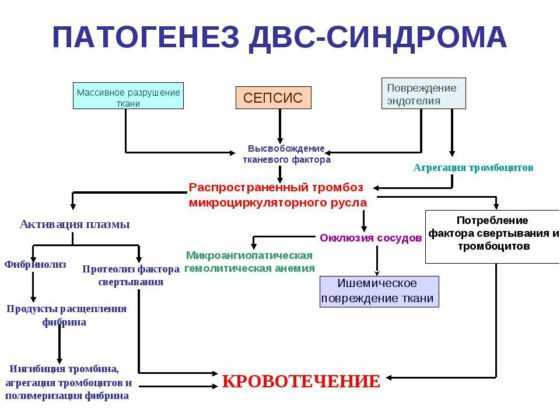
Причины ДВС синдрома обусловлены заболеваниями, которые его спровоцировали. Самыми распространенными пусковыми механизмами служат.
- Тяжелые инфекционные патологии – сепсис, сопровождающийся шоковым состоянием, вирусные процессы.
- Другие виды шока, который по своей сути является основной причиной ДВС-синдрома. К ним можно отнести травматический, гиповолемический, инфекционно-токсический и даже болевой.
- Любое терминальное состояние способно спровоцировать диссеминированное внутрисосудистое свертывание.
- Хирургические операции, особенно массивные, при которых используют аппараты искусственного кровообращения.
- Раковые заболевания.
- Гемодиализ.
- Чрезмерная кровопотеря.
- На фоне массивной гемотрансфузии также возникает эта патология.
- В акушерской практике ДВС-синдром встречается при отслоении плаценты, осложнении родовой деятельности эмболией околоплодными водами, токсикозах, резус-конфликте.
- Патологии сердечно-сосудистой системы.
Исходя из вышесказанного можно сделать вывод, что диссеминированное внутрисосудистое свертывание крови обусловлено тяжелыми патологическими процессами или терминальными состояниями. При этом у здоровых новорожденных деток патология практически не встречается. Здесь важно правильно его дифференцировать от других коагулопатий, таких как гемофилия или болезнь Виллебранда.
Стадии развития и формы ДВС-синдрома
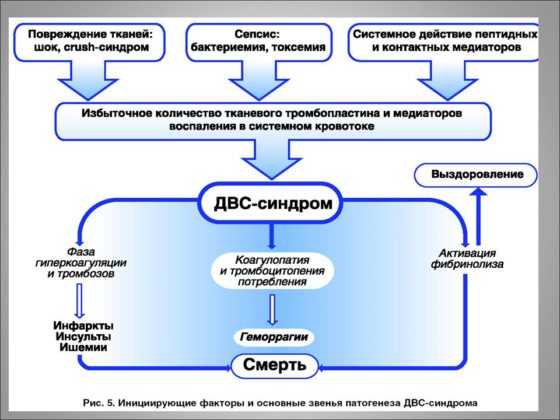
Врачи классифицируют это состояние по-разному. Все эти деления основываются на этиологических, патогенетических особенностях, а также вариантах клинического течения. С учетом механизмов запуска патологии, выделяют такие стадии ДВС-синдрома.
- Сначала возникает гиперкоагуляция.
- Она сменяется так называемой коагулопатией потребления, которая плавно сменяется третьей стадией.
- Гипокоагуляция – терминальная стадия шока, если на данном этапе не оказать помощь пациенту, то процент летальности будет очень высоким.
- Восстановительная, включает процесс восстановления организма после коррекции шокового состояния.
Патогенез
Патогенез ДВС-синдрома основывается на механизмах, протекающих во время всех его стадий. Несостоятельность гемостатической системы организма обусловлено повышенной стимуляцией свертывания крови, а также истощением антикоагулянтных и фибринолитических механизмов.
Патофизиология ДВС-синдрома зависит от многих факторов, которые служат активаторами процесса свертывания. Они действуют самостоятельно, либо же выступают медиаторами воздействия на эндотелий сосудистой стенки. Активаторами всех стадий ДВС-синдрома служат токсины, продукты жизнедеятельности бактерий, иммунные комплексы, снижение объема циркулирующей крови и многие другие. Именно они определяют варианты течения ДВС.
Патологическая составляющая основывается на стадиях процесса.
- Первой фазой ДВС-синдрома является гиперкоагуляция, во время которой внутри сосудов клетки начинают склеиваться. Она запускается за счет попадания в кровяное русло тромбопластина. Ее длительность составляет несколько минут.
- Патофизиология ДВС-синдрома включает коагулопатию потребления, при которой отмечается выраженный дефицит фибриногена и других факторов свертывания за счет быстрого расхода, а организм не успевает их возместить.
- Вторичный фибринолиз сопровождается гипокоагуляцией, кровь сворачивается очень медленно, либо не сворачивается вообще.
- Восстановление характеризуется остаточными явлениями или осложнениями.
Клинические проявления
Симптомы ДВС-синдрома не подвергаются сомнению при возникновении кожных проявлений (они могут называться геморрагическими проявлениями), снижения диуреза, поражении легких. Это главные признаки патологии.
Симптоматика обусловлена главным звеном патогенеза, это повышенная свертываемость крови. Первыми страдают паренхиматозные органы и кожа. Тяжесть состояния зависит от выраженности тромбообразования.
- При вовлечении кожи отмечается геморрагическая сыпь, она напоминает незначительные кровоизлияния, участки некроза ткани.
- Легкие реагируют развитием острой дыхательной недостаточности. Возникает одышка, тяжелые случаи сопровождаются отеком легких или остановкой дыхания.
- При избытке фибрина в плазме крови запускаются почечные проблемы – почечная недостаточность, терминальная стадия проявится анурией и электролитным дисбалансом.
- Поражение головного мозга определяется по наличию неврологической симптоматики.
Помимо вышеописанных изменений, у пациента могут развиваться массивные наружные или внутренние кровоизлияния, гематомы.
Диагностика ДВС-синдрома
Чтобы определить у больного наличие диссеминированного внутрисосудистого свертывания, необходимо тщательно собрать анамнестические данные и установить диагноз, которые спровоцировал это состояния. ДВС-синдром требует лабораторной диагностики, которая включает коагулограмму, общий анализ крови, исследование факторов свертывания крови. Очень важным моментом является определение степени тяжести больного для назначения адекватной коррекции.
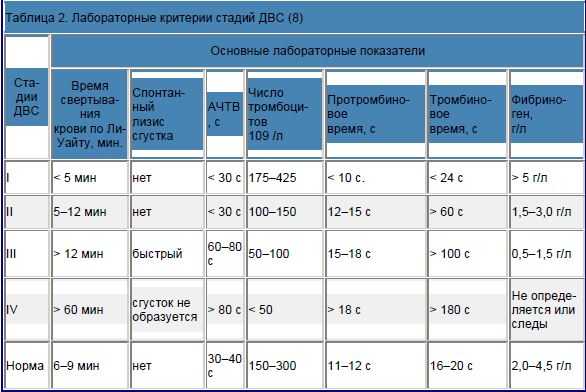
Необходимо учитывать то, что больной может кровоточить сразу из нескольких мест. При этом если развился хронический процесс или он не очень агрессивный, то гиперкоагуляцию можно обнаружить только при лабораторной диагностике.
Врач обязан назначить:
- анализ крови с целью определения тромбоцитов;
- коагулограмму, которая отобразит количество фибриногена, время свертывания крови, уровень тромбина, протромбина, АЧТВ.
Существуют специфические тесты – РФМК, Д-димер. Они выполняются методом иммуно-ферментного анализа.
Основными критериями ДВС-синдрома врачи считают определение фрагментированных эритроцитов, недостаточное количество тромбоцитов, снижение концентрации фибриногена. Также отмечается низкая активность антитромбина-III, увеличенная длительность АЧТВ и тромбинового времени. Слабое образование сгустка или его нестабильность косвенно указывают на нарушение гемостаза.
Врач обязан проверить функциональную работоспособность органов, которые первыми подвергаются шоку – почки, печень, легкие.
Хронический ДВС-синдром
Основными характеристиками хронического ДВС-синдрома являются.
- Постоянное увеличенное попадание в системный кровоток веществ, которые выступают активаторами системы гемостаза.
- Повышенная скорость образования фибрина внутри сосудов.
- Снижение потребления тромбоцитов.
- Вторичная активация фибринолиза отсутствует, также, как и генерализованный внутрисосудистый фибринолиз.
- Фибрин блокирует микроциркуляцию паренхиматозных органов, провоцируя их выраженную дисфункцию.
Острый процесс активируется за счет тромбопластина, попадающего в кровь из тканей, которые подверглись распаду за счет различных пусковых факторов. Это могли быть травмы, ожоги, хирургические манипуляции на органах-мишенях, деструктивные процессы, акушерские заболевания. Гораздо реже триггерами ДВС-синдрома становятся фосфолипиды эндотелия сосудистой стенки или форменных элементов крови. Такой механизм больше характерен для бактериальных процессов, шоковых состояний. Хроническое диссеминированное внутрисосудистое свертывание обусловлено меньшей агрессией вышеперечисленных факторов активации, что способствует его медленному началу, лучшему прогнозу для жизни пациента.
Лечение
Успешное лечение ДВС-синдрома возможно лишь в том случае, если состояние было диагностировано на ранних этапах его развития. Активные действия медицинского персонала необходимы при тяжелых проявлениях – кровотечениях, развитии полиорганной недостаточности. Неотложная помощь при ДВС-синдроме оказывается в условиях реанимации. Хронический процесс требует коррекции гемодинамики, электролитных нарушений, симптоматической терапии.
При остром течении необходимо быстро определить причину, после чего ее устранить. Это может быть экстренное родоразрешение, назначение мощных антибактериальных препаратов. Гиперкоагуляция корректируется фибринолитиками, антикоагулянтами, антиагрегантами. Пациенты с такой патологиях находятся под постоянным наблюдением медицинских работников, им проводится контроль системы гемостаза каждые 15-30 минут.
Заместительная терапия подразумевает гемотрансфузии, антифибролитические средства. Иногда возникает необходимость в применение гормональных препаратов, плазмаферезе, кислородотерапии. С целью восстановления микроциркуляции, функционального состояния внутренних органов назначается сосудистая и метаболическая терапия. Хронический процесс требует введения вазодилятаторов, антиагрегантов, гепаринов. Важно понимать, что лечение состояния сложное, требующее определенных знаний и умений со стороны врача. Именно от его сноровки зависит жизнь пациента.
gemato.ru
ДВС-синдром | Патологическая физиология
Образование тромбов лежит в основе синдрома диссеминированного внутрисосудистого свертывания крови (ДВС-синдром), который является одним из важнейших факторов в патогенезе и танатогенезе ряда заболеваний, а также терминальных состояний. ДВС-синдром проявляется в том, что за короткое время (часы) в мелких кровеносных сосудах образуются тромбы, причем в данном случае процесс не является локальным, а захватывает практически все сосудистое русло, приводя, таким образом, к генерализованным расстройствам гемодинамики.
Распространенность ДВС-синдрома столь велика, что это дало основание американскому ученому Дональду Мак-Кею высказать предположение о том, что этот процесс является промежуточным механизмом любого заболевания. Однако наиболее ярко этот синдром проявляется при эмболии околоплодными водами во время родов, отравлениях солями тяжелых металлов, повреждении форменных элементов крови в аппарате искусственного кровообращения, при поражении микроциркуляторного русла в динамике шоковых состояний, при анафилаксии, отторжении трансплантата, генерализованном поражении сосудистой стенки при сепсисе, риккетсиозах и т.д.
В динамике ДВС-синдрома различают следующие три стадии:
Первая стадия носит название коагуляционной и характеризуется резкой активацией процессов свертывания крови. Клиническая картина определяется расстройствами местного кровообращения, в зависимости от того, в каком сосудистом регионе наиболее активно образуются кровяные сгустки. В этот период происходит компенсаторная активация антисвертывающей системы крови, массивный выброс в кровь гепарина и стимуляция процессов фибринолиза. Если образование сгустков крови было кратковременным эпизодом, то гепарин затормозит процесс дальнейшей коагуляции, а фибринолитическая система растворит образовавшиеся кровяные сгустки и наступит выздоровление. Если же этого не произойдет, то либо больной погибнет от расстройств местного кровообращения, либо процесс перейдет во вторую стадию.
Вторая стадия этого синдрома носит название коагулопатии потребления и заключается в том, что на определенном этапе первой стадии происходит исчерпание запасов фибриногена и факторов свертывания крови. Вследствие этого процесс свертывания прекращается, но на фоне уже имеющихся микротромбов начинается массивное кровотечение, поскольку дефект любого травмированного сосуда (от аорты до капилляра) не прикрывается тромбом, так как нет фибриногена и других факторов свертывания. Если данная стадия ДВС-синдрома совпадает, например, с операцией или ранним послеоперационным периодом, то может возникнуть на первый взгляд парадоксальная ситуация: на фоне образования микротромбов больной погибает от профузного кровотечения из перерезанных сосудов. С другой стороны, прекращение тромбообразования приводит и к снижению активности фибринолитической системы, так что уже образовавшиеся микротромбы перестают растворяться.
Третья стадия - стадия фибринолиза - наступает в том случае, если фибринолиз не только не подавлен, но продолжает активироваться.
Предлагается выделить в ДВС-синдроме и четвертую стадию — стадию восстановления, клиническую картину которой определяют дистрофические изменения и множественные некрозы в органах. Естественно, эта стадия развивается лишь в том случае, если в течение первых трех стадий не наступила смерть больного.
При ДВС-синдроме различают пять видов микротромбов в зависимости от того, какие компоненты в тромбе преобладают: фибриновые, тромбоцитарные, эритроцитарные, лейкоцитарные и смешанные (перечисление идет в порядке снижения частоты образования тромбов).
www.4astniydom.ru
Реферат
ГБОУ ВПО ИЖЕВСКАЯ ГОСУДАРСТВЕННАЯ МЕДИЦИНСКАЯ АКАДЕМИЯ
КАФЕДРА ПРОПЕДЕВТИКИ ВНУТРЕННИХ БОЛЕЗНЕЙ С КУРСОМ СЕСТРИНСКОГО ДЕЛА
«ДВС – синдром»
Проверила: ассистент, к.м.н.
Пенкина И.А.
Выполнила: студентка 304 гр.
лечебного факультета
Бекташева Е.О.
Ижевск
2013 Г.
ОГЛАВЛЕНИЕ
ВВЕДЕНИЕ____________________________________________________3
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ_______________________________4-8
КЛИНИКА И ДИАГНОСТИКА______________________________9-10
ЛЕЧЕНИЕ ДВС-СИНДРОМА_______________________________11-14
ЗАКЛЮЧЕНИЕ________________________________________________15
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ____________________16
ВВЕДЕНИЕ
ДВС - (диссеминированное внутрисосудистое свёртывание) -неспецифический общепатологический процесс, в основе которого лежит активация свертывания крови и агрегации тромбоцитов, ведущая к циркуляции избыточного количества тромбина и образованию микросгустков и агрегатов клеток, блокирующих микроциркуляцию в органах и вызывающих их дисфункцию, с вторичной активацией фибринолиза и истощением плазменных ферментных систем, нередко сопровождающимся профузными кровотечениями.
ДВС‑синдром – наиболее распространенный вид патологии гемостаза.Его основой является генерализованное свертывание крови в сосудах микроциркуляторного русла с образованием большого количества микротромбов и агрегатов кровяных клеток. При этом происходит блокировка нормального кровообращения в большинстве органов и систем, приводящая к развитию в них глубоких дистрофических изменений. Вслед за интенсивным свертыванием крови развиваются гипокоагуляция (снижение способности крови к свертыванию), тромбоцитопения (снижение количества тромбоцитов в единице объема крови) и геморрагии (кровотечения). Синдром возникает при самых разнообразных заболеваниях, всегда приводя к потере жидкостных свойств крови и нарушению ее циркуляции в капиллярах, что несовместимо с нормальной жизнедеятельностью организма. Вместе с тем тяжесть, распространенность и скорость развития ДВС‑синдрома очень разнообразны – от молниеносных смертельных форм до латентных (скрытых) и затяжных, от генерализованного свертывания крови до региональных и органных тромбогеморрагий.
1. Этиология и патогенез
Частота ДВС‑синдрома при разных видах патологии неоднородна. При одних заболеваниях и воздействиях он возникает обязательно, становясь неотъемлемой частью патологического процесса, при других встречается реже.
ДВС-синдром вызывают:
1. Генерализованные инфекции и септические состояния (бактериемия, вирусемия), в том числе при абортах, в родах, при длительной катетеризации сосудов.
2. Все виды шока: геморрагический, травматический, ожоговый, анафилактический, септический и кардиогенный. ДВС-синдром является обязательным спутником шока любого происхождения. При этом степень тяжести рассматриваемого синдрома находится в прямо пропорциональной зависимости от выраженности и продолжительности шокового состояния.
3. Оперативные вмешательства, являющиеся особо травматичными для больного (особенно при злокачественных новообразованиях, операциях на паренхиматозных органах, использовании аппарата искусственного кровообращения, внутрисосудистых вмешательствах).
4. Терминальные состояния.
5. Острый внутрисосудистый гемолиз, в том числе при несовместимых трансфузиях.
6. Акушерская патология, в частности: предлежание плаценты, преждевременная отслойка плаценты или ручное ее отделение, закупорка сосудов матки околоплодными водами, внутриутробная смерть плода. При всех перечисленных состояниях тяжелый ДВС‑синдром регистрируется в 20–35% случаев. Его проявления встречаются гораздо чаще при позднем токсикозе беременных, при инфицировании околоплодных вод, кесаревом сечении, обильных кровотечениях, интенсивном массаже матки. Изредка ДВС‑синдром развивается и при нормальных родах.
7. Опухоли, особенно гемобластозы, лейкозы, рак легкого, печени, поджелудочной, предстательной железы, почки. При острых лейкозах ДВС‑синдром на разных этапах болезни выявляется у 33–45% больных.
8. Различные заболевания, приводящие к деструкции печени, почек, поджелудочной железы и других органов и их систем.
9. Ожоги различного происхождения.
10. Иммунные и иммунокомплексные болезни, в том числе системная красная волчанка, ревматизм, ревматоидный артрит с висцеральными поражениями, геморрагический васкулит Шенлейна – Геноха, гломерулонефрит.
11. Гемолитико‑уремический синдром.
12. Аллергические реакции.
13. Обильные кровотечения.
14. Тромботическая тромбоцитопеническая пурпура (Б. Мошкович).
15. Острые отравления кислотами, щелочами, змеиными ядами.
16. Переливания больших объемов крови; введения препаратов крови, содержащих активированные факторы свертывания.
17. Лечение препаратами, вызывающими агрегацию тромбоцитов, повышающими свертываемость крови и снижающими ее противосвертывающий и фибринолитический потенциалы, особенно при комбинированном их применении (α‑адреностимуляторы, синтетические прогестины, аминокапроновая кислота и другие ингибиторы фибринолиза).
18. Неправильное применение фибринолитиков и антикоагулянтов в дозах, вызывающих истощение резерва антитромбина III и фибринолитической системы.
19. Лечение препаратами дефибринирующего действия – арвином, анкродом, дефибразой, рептилазой (терапевтический ДВС‑синдром).
20. Множественные и гигантские ангиомы (типа Казабаха‑Мерритта).
Причин, способных вызвать развитие у больного ДВС‑синдрома, известно в настоящее время огромное количество. Несмотря на это, основой формирования синдрома является активация свертывающей системы крови и тромбоцитарного гемостаза разнообразными факторами эндогенного происхождения. К таким факторам в первую очередь относятся: тканевой тромбопластин, продукты распада тканей и форменных элементов крови, фрагменты поврежденного эндотелия сосудов. Последнее условие развития этой патологии может возникать в случае воздействия инфекционного агента, иммунных комплексов, компонентов системы комплемента и других факторов. Помимо того, в механизме ДВС‑синдрома играют немаловажную роль следующие экзогенные факторы: разнообразные бактерии и вирусы, риккетсии, лекарственные препараты, вещества, применяемые в качестве кровезаменителей, околоплодные воды, яды различных змей, глубокие нарушения кровообращения (в том числе при обильной кровопотере), гипоксия тканей, ацидоз, нарушения микроциркуляции, первичная или вторичная депрессия противосвертывающих механизмов (дефицит антитромбина III) и компонентов фибринолитической системы (дефицит плазминогена и его активаторов, резкое повышение антиплазминовой активности), недостаточная функциональная способность либо генерализованное поражение сосудистого эндотелия, снижение его антитромботической активности. Возможно комбинированное участие нескольких перечисленных механизмов.
В течение ДВС-синдрома выделяют несколько стадий, характеризующихся определенными нарушениями гемокоагуляции и клинической картиной.
I стадия ДВС-синдрома — фаза гиперкоагуляции. Продолжительность этой фазы варьирует в широких пределах. Эта фаза может развиваться очень бурно при быстрой и значительной активации свертывающей системы с массивным диссеминированным внутрисосудистым свертыванием и тяжелым шоком. Период гиперкоагуляции характеризуется активацией плазменных систем свертывания крови, внутрисосудистой агрегацией тромбоцитов и других форменных элементов крови, нарушением микроциркуляции в разных органах в результате блокады сосудистого русла массами фибрина и агрегатами клеток. Фаза гиперкоагуляции также может развиваться постепенно при медленном поступлении малых доз протромбиназы. Однако медленное течение может закончиться взрывом с быстрым развитием ДВС-синдрома. Кроме диссеминированного внутрисосудистого свертывания, в ряде случаев отмечаются только локальное ограниченное внутрисосудистое свертывание и тромбообразование. Такой процесс наблюдается в гигантской гемангиоме Казабаха — Мерритта. Б. И. Кузник (1979) установил, что в патогенезе ДВС-синдрома важную роль играют также лейкоциты. Особо велико значение лейкоцитов в развитии ДВС-синдрома при гемобластозах. Роль лейкоцитов определяется их свойством высвобождения факторов свертывания, способностью к адгезии и агрегации, тесному взаимодействию с эндотелием сосудов и тромбоцитами в процессе тромбообразования.
II стадия ДВС-синдрома — фаза гипокоагуляции, которая сменяет фазу гиперкоагуляции и обусловлена потреблением значительной части имеющихся в организме фибриногена, факторов XIII, V, VIII и других прокоагулянтов, а также тромбоцитов. Одновременно в крови накапливаются патологические ингибиторы свертывания крови, в частности продукты деградации фибрина и фибриногена (ПДФ), обусловливающие увеличение антикоагулянтной активности крови. Концентрация гепарина в крови существенно не изменяется, однако комплексные соединения гепарина с фибрином играют большую роль в нарушении гемостаза. Внутрисосудистое свертывание крови также вызывает активацию фибринолитической системы, ведущей к растворению кровяных сгустков и создающей предпосылки для развития геморрагического синдрома. Естественно, что включение механизмов, обусловливающих гипокоагуляцию, имеет определенную последовательность и значимость в течение всего процесса: истощение механизмов свертывания крови — накопление продуктов деградации фибрина — активация фибринолитической системы.
III стадия ДВС-синдрома наступает по мере дальнейшего течения процесса, если он не закончился летальным исходом. В этой стадии в той или иной мере происходит восстановление функции органов, которое зависит от степени их поражения (дистрофические изменения, склероз и т. д.). Стадия может закончиться полным выздоровлением. Возможно развитие тяжелых осложнений уже в отсутствие как такового ДВС-синдрома — почечная, печеночная недостаточность, неврологические, кардиальные и другие осложнения. В. П. Балуда (1979) выделяет несколько основных причин смерти при остром течении ДВС-синдрома: 1. Гибель организма может наступить мгновенно при закупорке магистральных сосудов жизненно важных органов. 2. Если организм не погибает в первые минуты от закупорки сосудов кровяными сгустками, то летальный исход может быть определен развитием тяжелого геморрагического синдрома в виде локальных кровотечений в месте повреждения сосудов (операции, травмы) или генерализованных кровотечений, кровоизлияний во внутренние органы. 3. В более поздний период летальный исход возможен в связи с тяжелым нарушением функции отдельных органов (почки, печень, легкие, селезенка, миокард, головной мозг, гипофиз, надпочечники, пищеварительный тракт).
studfiles.net
Патологическая физиология - Диссеминированное внутрисосудистое свертывание крови (ДВС-синдром)
Диссеминированное внутрисосудистое свертывание крови (ДВС-синдром)
ДВС-синдром – неспецифический патологический процесс, характеризующийся распространенным свертыванием крови и агрегацией клеток крови в микроциркуляции, ведущим к блокаде микроциркуляции, гипоксии, ацидозу, дистрофии органов, развитию полиорганной недостаточности. ДВС-синдром осложняет самые разнообразные формы патологии: инфаркт миокарда, кардиогенный шок, различные виды злокачественных новообразований, обширные оперативные вмешательства, тяжелую гипоксию, акушерскую патологию, переливание несовместимой крови, системную красную волчанку, иммуноком-плексные заболевания, цирроз печени.
Диссеминированное внутрисосудистое свертывание крови – динамический патологический процесс, характеризующийся последовательной сменой генерализованной гиперкоагуляции с внутрисосудистым свертыванием крови, агрегацией тромбоцитов, блокадой микроциркуляции и гипокоагуляции с гипофибриногенемией и тромбоцитопенией потребления.
Касаясь патогенеза диссеминированного внутрисо-судистого свертывания крови, следует отметить общие закономерности его развития, включающего следующие инициирующие механизмы.
1. Первичное поражение сосудистой стенки, десквамация эндотелия, обнажение субэндотелиальных белков
2. Первичное преимущественное воздействие патогенного фактора на тромбоциты.
3. Сочетанное одномоментное воздействие бактериальных, токсических, иммуноаллергических факто-22б ров на тромбоцитарно-сосудистое и коагуляционное звенья системы гемостаза.
4. Развитие альтернативных механизмов гемокоагуляции за счет активации моноцитарно-макрофагаль-ного и эритроцитарного звеньев системы гемостаза.
Различные по природе патогенные факторы, вызывают активацию прокоагулянтной системы крови за счет массивного генерализованного повреждения сосудистой стенки, повышения ее адгезивных свойств, активации тромбоцитарного звена системы гемостаза, а в ряде случаев – моноцитарно-макрофагально-го и эритроцитарного альтернативных путей гемокоагуляции.
В развитии ДВС-синдрома следует выделять следующие фазы:
1) гиперкоагуляцию и агрегацию клеток крови – I фаза;
2) переход гиперкоагуляции в гипокоагуляцию – II фаза;
3) стадию глубокой гипокоагуляции вплоть до полной несвертываемости крови III фаза;
4) восстановительную стадию при благоприятном течении заболевания или формирование полиорганной недостаточности – IV фаза.
ДВС-синдром может носить острый, подострый, хронический и рецидивирующий характер.
Острая форма возникает при септических инфекциях, обширных оперативных вмешательствах, кровопотере, ожогах, переливании несовместимой крови и т. д.
Подострое течение ДВС-синдрома имеет место при почечной недостаточности, злокачественных новообразованиях, лейкозах.
Рецидивирующие и хронические формы могут иметь место при раке, системных воспалительных, аутоиммунных заболеваниях.
cribs.me
ТЕМА: ПАТОФИЗИОЛОГИЯ ГЕМОСТАЗА. ГЕМОРРАГИЧЕСКИЕ СОСТОЯНИЯ. ДВС
⇐ ПредыдущаяСтр 8 из 12Следующая ⇒ЦЕЛЬ ЗАНЯТИЯ:изучить изнать определение понятий реология и гемостаз,основные системы этих процессов; определение понятия, классификацию геморрагических синдромов: этиологию, патогенез и основные клинические проявления при патологии сосудистой стенки, клеточного звена гемостаза и плазменных факторов свертывания крови, компонентов антикоагуляционной и фибринолитической систем.
Базисные знания, необходимые для усвоения данной темы:
- Гистология (кроветворение, морфо-функциональные особенности тромбоцитов)
- Физиология (свертывающая система крови: тромбоцитарное и плазменное звено)
- Биохимия (каскадный механизм взаимодействия факторов свертывания крови)
Перечень вопросов для подготовки к занятию:
- Определение понятия «гемостаз» и «реология»
- Основные компоненты реологии и гемостаза
- Определение и классификация геморрагических диатезов.
- Геморрагические состояния, обусловленные патологией сосудистой стенки
- Геморрагические состояния, обусловленные патологией клеточного звена гемостаза. Роль тромбоцитов в гемостазе.
- Тромбоцитопении, Тромбоцитопатии ( болезни Виллебранда, тромбастения Гланцмана, синдром Бернара-Сулье).
- Геморрагические состояния, обусловленные патологией плазменных факторов свертывания крови. Пути активации коагуляционного каскада (внешний и внутренний путь).
- Наследственные и приобретенные коагулопатии.
- Этиология, патогенез гемофилий.
- ДВС - синдром. Этиология. Патогенез. Стадии.
- Клинико-лабораторные методы исследования системы гемостаза.
Перечень вопросов для самостоятельного изучения студентами:
1. Структура и функции тромбоцитов.
2. Взаимодействие плазменных факторов свертывания крови.
3. Эндотелий – его функции и дисфункции.
4. Геморрагический синдром, классификация. Типы кровоточивости (по Баркагану)
5. Современные представления о патогенезе ДВС - синдрома. Этиология, механизмы развития, стадии, лабораторная диагностика.
6. Клинико-лабораторные методы исследования системы гемостаза.
Текстовые задания для самостоятельной работы студентов
Дать определения терминам
гемостаз
реология
геморрагический синдром
вазопатии
тромбоцитопатии
тромбоцитопении
коагулопатии
этапы свертывания крови
внутренний путь свертывания крови
внешний путь свертывания крови
Учебная карта занятия:
Тестовые задания для контроля исходного уровня знаний студентов
1. ТРОМБОРЕЗИСТЕНТНОСТЬ СОСУДИСТОЙ СТЕНКИ ОБУСЛОВЛЕНА (1):
1) выделением тканевого тромбопластина
2) синтезом тканевого активатора плазминогена
3) активацией прокоагулянтов
4) синтезом простациклина I2
5) синтезом фактора Виллебранда
2. АГРЕГАЦИЮ ТРОМБОЦИТОВ СТИМУЛИРУЮТ СЛЕДУЮЩИЕ АГЕНТЫ (2):
1) тромбин
2) плазмин
3) АДФ
4) простациклин I2
5) гепарин
3. РАЗВИТИЕ ГЕМОРРАГИЧЕСКОГО СИНДРОМА МОЖЕТ БЫТЬ СЛЕДСТВИЕМ (2):
1) повышения проницаемости сосудистой стенки
2) дефицита прокоагулянтов
3) повышенного образования протромбина
4) повышение концентрации ингибиторов фибринолиза
5) уменьшения количества тромбоцитов
4. УКАЖИТЕ ИЗМЕНЕНИЯ, ХАРАКТЕРНЫЕ ДЛЯ ГЕМОФИЛИИ (2):
1) снижение количества тромбоцитов
2) удлинение времени свертывания крови
3) нарушение агрегации тромбоцитов
4) дефицит фактора Виллебранда
5) снижение прокоагулянтной активности фактора VIII
5. УКАЖИТЕ ИЗМЕНЕНИЯ, ХАРАКТЕРНЫЕ ДЛЯ БОЛЕЗНИ ВИЛЛЕБРАНДА (2):
1) увеличение длительности капиллярного кровотечения
2) сокращение длительности капиллярного кровотечения
3) повышение количества и активности фактора Виллебранда
4) дефицит фактора Виллебранда
5) дефицит фактора VIII
6. СНИЖЕНИЕ ВРЕМЕНИ СВЕРТЫВАНИЯ КРОВИ ПРИ ЦИРРОЗЕ ПЕЧЕНИ СВЯЗАНО С (1):
1) дефицитом витамина С
2) дефицитом фактора Виллибранда
3) снижением количества плазменных факторов свертывания крови
4) тромбоцитопатией (болезнь серых тромбоцитов)
5) тромбоцитопенией
7. ДЕФИЦИТ КАКИХ ФЕРМЕНТОВ В ТРОМБОЦИТАХ ПРЕПЯТСТВУЕТ ОБРАЗОВАНИЮ ТРОМБОКСАНА А2 (1):
1) низкая активность циклооксигеназы;
2) высокий уровень циклической АМФ;
3) дефицит фосфолипазы А2:
4) низкий уровень циклической АМФ;
5) дефицит цГМФ
8. АКТИВНЫЙ ФАКТОР ХАГЕМАНА НЕПОСРЕДСТВЕННО ЗАПУСКАЕТ(1):
1) 1 стадию свертывания крови
2) 2 стадию свертывания крови
3) 3 стадию свертывания крови
4) С3 фрагмент комлемента
5) антикоагулянтную систему
9. УКАЖИТЕ ПРОЯВЛЕНИЯ, ХАРАКТЕРНЫЕ ДЛЯ ТРОМБОЦИТОПАТИЙ (2):
1) снижение адгезивной и агрегационной функции тромбоцитов
2) повышение адгезивной и агрегационной функции тромбоцитов
3) геморрагии
4) тромбоз крупных вен
5) нарушение образования протромбина
10. УКАЖИТЕ КОЛИЧЕСТВО ТРОМБОЦИТОВ В КРОВИ ПРИ ТРОМБОЦИТОПЕНИИ (1):
1) 700´10 9/л
2) 500´10 9/л
3) 350´10 9/л
4) 250´10 9/л
5) 150´10 9/л
Содержание темы
Реологические (текучие свойства крови), как и противоположное состояние - гемостаз обеспечиваются многокомпонентной системой, не имеющей единой органной локализации. При повреждении стенки сосудов имеет место остановка кровотечения или гемостаз.Гемостаз - эволюционно сложившаяся защитная реакция организма, основа которой взаимодействие компонентов крови, стенки сосудов, тканей и органов, обеспечивающих резистентность стенки сосудов к механическим воздействиям и остановку кровотечения из поврежденного сосуда. Морфологическим проявлением гемостаза является образование тромба.
Системы и органы, ответственные за процессы реологии и/или гемостаза можно распределить следующим образом:
-сосудистая стенка с эндотелиоцитами
-специализированные клетки - тромбоциты
-плазменные факторы свертывания крови
-антикоагулянтная система
-фибринолитическая система
-печень, как основной орган, обеспечивающий основные плазменные прокаогулянтные и антикоагулянтные компоненты.
-все клетки организма, в том числе и клетки крови, способны к выработке прокоагулянтов, компонентов фибринолитической и антикоагулянтной систем.
Каждая из систем, коагулянтная, антикоагулянтная и фибринолитическая - многофакторны. Нарушение взаимодействия внутри системы или между системами будет проявляться либо в склонности к тромбообразованию, либо в склонности к кровоточивости (геморрагические диатезы).
Роль сосудистой стенки в гемостазе и поддержании реологических свойств крови.
Эндотелиальные клетки внутри кровеносных сосудов формируют полупроницаемый барьер между внутрисосудистым сектором и интерстициальным пространством. Монослой эндотелиальных клеток –первый защитный барьер в предотвращение геморрагических проявлений и тромбоза.
Все компоненты сосудистой стенки - эндотелий, субэндотелий, средняя и наружная оболочка участвуют в реакции на повреждение.
Антикоагулянтные свойства эндотелия.
- отрицательный заряд цитоплазматической мембраны эндотелия
- синтез гепарин-сульфата
-синтез основного физиологического антикоагулянта- антитромбина III (АТ III) и секреция в просвет сосуда комплекса гепарин-сульфат-АТ III
- синтез тромбомодулина (гликопротеин в составе мембраны эндотелия).
- синтез протеина С и протеина S (антикоагулянты)
- фиксация с помощью специальных рецепторов комплекса гепарин-антитромбин III
- угнетает прокоагулянтную функцию моноцитов
- синтезирует ингибитор адгезии лейкоцитов.
- синтез простагландина (простациклина) I2 (PGI2).
- синтез оксид азота
- синтез активатора плазминогена
Прокоагулянтные свойства.
- cинтез фактора Виллибранда, (антиген фактора VIII), компонент необходимый для адгезии тромбоцитов
- активация фактора XII (фактор контакта-Хагемана), образование протромбиназного комплекса
- секреция тканевого фактора (ТФ), высвобождаемого при активации эндотелиальных клеток. Индукторами синтеза ТФ могут служить тромбин, липополисахарид (ЛПС), цитокины, гипоксия, окисленные липопротеиды низкой плотности (ЛПНП).
- связывание факторов: IХа (антигемофильный глобулин В - ф-р Кристмасса), VIIIa (антигемофильный глобулин А), высокомолекулярный кинин.
- содержат фактор V.
-АДФ; при выделении из эндотелиальных клеток АДФ связывается с рецепторами на тромбоцитах и индуцирует их агрегацию.
- эндотелин 1, вазоконстриктор.
ФАТ – фактор активирующий тромбоциты.
- IL-1, TNF-α
- тромбоксан А2, продукт метаболизма арахидоновой кислоты - обладает местным вазоконстрикторным действием, способствует активации тромбоцитов
- ингибиторы активатора плазминогена, (PAI-I, PAI-2).
- через экспрессию на клеточной мембране адгезивных молекул способствуют адгезии лейкоцитов и моноцитов
Клеточное звено гемостаза.
Тромбоциты – безъядерные клетки крови, наименьшие по размеру форменные элементы крови, образуются из самых крупных костномозговых клеток – мегакариоцитов.
Читайте также:
lektsia.com
ПАТОФИЗИОЛОГИЯ СИСТЕМЫ КРОВИ
ПАТОФИЗИОЛОГИЯ СИСТЕМЫ КРОВИ
Циркулирующая кровь, депонированная кровь, органы кроветворения, кроверазрушения.
Изменения объема крови:
Гиперволемия:
простая – объем крови увеличивается за счет эритроцитов и плазмы. При переливании крови.
полицитемическая за счет объема клеток. Эритремия, эритроцитоз.
олигоцитемическая – за счет объема плазмы. При заболеваниях почек.
Патофизиологическое значение: при полицитемической – увеличивается вязкость крови и возникает сердечная недостаточность, активируется свертывающая системы и образуются тромбы.
При простой и олигоцитемической возникает плазморея и сгущение крови, что ведет к сердечной недостаточности и отеку легких.
Гиповолемитя:
1.простая – кровопотеря
2.олигоцитемическая – через несколько часов после кровопотери
3. полицитемическая – при обезвоживании.
ПФЗ: так как наблюдается гиповолемия, то снижается венозный возврат и падает сердечный выброс и АД. Возникает централизация кровообращения и ишемия тканей. В тканях развивается ацидоз, ведущий к депонированию крови и прогрессирующему падению АД. В результате развивается полиорганная недостаточность.
ОСТРАЯ МАССИВНАЯ КРОВОПОТЕРЯ
3 механизма развития:
разрыв –
разъедание
увеличение проницаемости сосудов
кровотечения может быть:
сверх острые возникает при разрыве аневризмы аорты и сердца. При ранении магистральных сосудов. Смерть через геморргический шок.
острые травмы, внутренние заболевания (легочные кровотечения, желудочные, маточные.
хронические при язвенной болезни, опухоль , постгеморрагические анемии.
Кровопотеря – это потеря не менее 500мл. крови в течение 10 минут.
Дефицит 10% ОЦК – только увеличение венозного давления
От 10% - 25% падение венозного давления и умеренная падение АД и тахикардия
25-30% клиника постгеморрагического шока, падение АД до 80 и менее, тахикардия 120 и более, вены спадаются, что ведет к полиорганной недостаточности.
30% такая кровопотеря называется массивной.
Компенсация острой кровопотери:
1 стадия:
рефлекторно-сосудистая: непосредственно после падения АД активируются бао- волюморецепторы, активирующие САС и возникает гиперКАемия.спазм периферических сосудов: выброс крови из депо(аутогематрасфузия), централизация кровотока, депонирования крови.
2 стадия:
гидримическая: через 6-18 часов. Гиповолемия активирует рецепторы, приводя к активации РААС и выбросу альдостерона гиперосмолярность выброс АДГ и задержки воды возникает гемодилюция. Проницаемость сосудистой стенки увеличивается и жидкая лимфы и межклеточная жидкость поступают в кровь.
3стадия: через 3-7 дней
костномозговая: гипоксия активирует эритропоэз. Возникает ретикулоцитарный криз.
Величина смертельной кровопотери зависит от многих факторов одновременно:
50% крови быстрая смертельная кровопотеря
потеря эритроцитов при массивной кровопотери не имеет значения. Потеря 1/3 плазмы смертельно. Опасно снижение объема ОЦК. При кровопотери 25% ОЦК вплоть до шока, тогда гемическая гипоксия присоединяется к циркуляторной. Острая массивная кровопотеря вызывает целый комплекс изменений – синдром острой кровопотери.
Нарушение жизнедеятельности при острой массивной кровопотери:
снижение АД ведет к спазму артериол и депонированию крови
из-за потери плазмы, снижается ОЦК и гиповолемия, возникают циркуляторные расстройства и шок – полиорганная патология.
Любое повреждение сосуда сопровождается активицией свертывающей системы и развитием ДВС-синдрома – полиорганная недостаточность.
Организм может перенести потерю 70% крови, если бы не активировалась свертывающая система, так как она приводит к гибели организма.
Изменения вязкости крови:
Движение крови возможно, благодаря определенной структуры крови и её скорости движения.
Факторы влияющие на вязкость:
Изменения химического состава плазмы – избыток липидов, дегидратация, эритроцитоз
Изменение количества форменных элементов – эритроцитоз, полицитемия, гипертромбоцитоз
Изменение гемоциркуляции – шок, коллапс, сердечная недостаточность, инфаркт миокарда.
Агрегация форменных элементов ведет к замедлению кровотока и увеличению вязкости крови, поэтому увеличивается нагрузка на сердце. Увеличение вязкости ведет к активации свертывающей системы и образованию тромбов. Возникает симптоматическая гипертония и за счет увеличения нагрузки на сердце, развивается гипертрофия. Все выше перечисленное ведет нарушению микроциркуляции.
ПАТОФИЗИОЛОГИЯ СВЕРТЫВАЮЩЕЙ И ПРОТИВОСВЕРТЫВАЮЩЕЙ СИСТЕМЫ.
Свертывающая система:
плазменные прокоагулянты
2.тромбоцитарные прокоагулянты
эритроцитарные прокоагулянты
плазменные прокоагулянты:
I фибриноген - фибрин
II протромбин - тромбин
III тромбопластин: кровяной и тканевой
IV кальций
V проакцилирин
VIакцилирин VIIпроконвертин VIIIантигемофильный глобулин А IХантигемофильный глобулин В фактор Кистмаса
Хфактор Стюарта - Праура
ХIантигемофильный глобулин С ХIIХагемана
ХIII фибринстабилизирующий фактор
Свертывание крови:
1 фаза – образование тромбопластина
2 фаза – тромбина
3 фаза – фибрина
активация свертывающей системы уравновешивается противосвертывающей системой.
Противосвертывающая система:
физиологические антикоагулянты: гепарин, антитромбин III
иммунная система: иммуноглобулины имеют антиферментную активность, их концентрация возрастает в процессе свертывания., продукты деградации фибрина 5 и 8
фибринолитическая система:
антифибринокиназы антифибринолизин
тканевые фибринокиназы профибринолизин фибринолизин
Геморрагические диатезы и синдромы:
Это все формы патологии, которые характеризуются кровоточивостью системного характера, не связанной с местными деструктивными процессами, возникают спонтанно.
Кровоточивость: это временное или постоянное, врожденная или приобретенная наклонность повторным кровотечениям, возникающих самостоятельно.
1 тип гематомный: при коагулопатиях, характеризуется образованием гематом обширных, напряженных, подкожных, в мышцах, в суставах (гемартрозы), в почках, забрюшинные, головном и спинном мозге, в кишечной стенке – непроходимость, заглоточные, ретроорбитальные – поражение зрительного нерва. Гематомы могут сдавливать сосуды и приводить к ишемии и некрозу. Сдавливая нервы нарушается чувствительность.
Обильными длительными кровотечениями (кожа, слизистые, почечные, менструальные, маточные).
2 тип микроциркуляторный (нарушение тромбоцитарной системы) – возникают при повреждении мелких сосудов – на коже появляются петехии и синячки. Повторные кровотечения – десневые, носовые. Опасны мелкие операции – удаление зубов, удаление щитовидной железы. Длительные метро- и меноррагии.
3 тип: гематомно-микроциркуляторный: ДВС-синдром, болезнь Виллебранта. На коже петехии, гематомы, кровотечения из слизистых.
Система гемостаза:
1.свертывающая и противосвертывающая
2.тромбоцитарная система
3.сосудистая стенка
геморрагические диатезы:
коагулопатии
тромбоцитарные нарушения
поражения сосудистой стенки (вазопатии)
комбинированные поражения
КОАГУЛОПАТИИ:
1 группа – нарушение 1 фазы свертывания (образования тромбопластина).
Гемофилии А,В – наследуются рецессивно сцеплено с полым. Широко распространены, болеют преимущественно мужчины. У женщин снижена активность соответствующего фактора. Течение: кровоточивость на 1 году жизни, небольшие травмы вызывают длительные месяцами кровотечения, угрожающие жизни. Спонтанно или при повреждении образуются гематомы.
Гемофилия С – наследуется доминантно, протекает в легкой форме, непостоянно, мало выражена. У гетерозигот нет изменений свертывающий системы.
2 группа: нарушкение 2 фазы – образования тромбина.
Гемофилиодные состояния:
Характеризуются кровоточивостью по типу гемофилий, но в присутствие глобулинов. Наследуются аутосомнорецессивно, гематомный тип кровоточивости.в тяжелых случаях гематомно-микроциркуляторный.
Гипопроакцилиринемия – парагемофилия.
Гипопроконвертинемия – псевдогемофилия: гематомный тип кровоточивости + петехии в складках, кровавый пот и слезы. Существуют бессимптомные формы.
Болезнь Стюарта-Прауэра- болеют женщины, наряду с гематомным типом кровоточивости ,длительные кровотечения – метро- и меноррагии.
Врожденный дефект образования протромбина: рецессивный тип наследования, гематомный тип кровоточивости.
При авитаминозе К, так как он необходим для синтеза 2,7,9,10 факторов.
3 группа: обусловлена нарушением 3 фазы и образованием фибрина.
Врожденная афибриногенемия – рецессивный тип наследования, кровь вообще никогда не свертывается, обильные кровотечения, гематомы – обширные, при этом избирательно возникают в головном мозге. Живут до 30 лет. У женщин при менструациях обильных кровотечений нет.
Приобретенные фибриногенпении: при тяжелых деструктивных процессах паренхиматозных органов, при патологических или тяжелых родах. Из тканей разрушающихся выделяется тканевые фибринокиназы,, что способствует активации фибринолитической системы. Фибринолитическая пурпура.
Наследственный дефект антитромбина III: доменантный путь наследования, повышается активность свертывающей системы, тромбофелия, образуются тромбы в подвздошных венах, тромбозы мозговых и коронарных сосудов, ТЭЛА.
Гиперкоагуляционный синдром: при замедлении кровотока активируется свертывающая система и тромбоцитарная система. Тоже самое при тяжелых инфекционных заболеваниях, опухолях, травме. Все эти состояния ведут к тромбообразованию в микроциркуляторном русле. Сам по себе гиперкоагуляционный синдром характеризуется повышенной активностью тромбоцитарной и свертывающей системой, однако эта активность уравновешивается противосвертывающей системы. Но это равновесие легко нарушается.
Приобретенные коагулопатии:
трансплацентарная передача ингибиторов прокаогулянтов – геморрагическая болезнь новорожденных.
При заболеваниях печени: все плазменные прокоагулянты , кроме 10 синтезируются здесь.
Патология почек, нефротический синдром: возникает протеинурия, что ведет к снижению синтеза прокоагулянтов.
Ожоги, травмы, злокачественные опухоли.
Функции тромбоцитов:
Ангиотрофическая ( проницаемость, ломкость сосудов, петехии, ангиопатии)
Тромбоцитарная тромбокиназа – 1 фаза свертывания
Тромбостенин – ретракция кровяного сгустка
Тромбоксан, серотонин – тонус микрососудов, их констрикция
Адгезивноагрегационная – тромбообразование
2 группа: тромбоцитарные нарушения:
1) тромбоцитопении- могут быть наследственными, нарушение образования мегакариоцитов, но чаще они имеют иммунный характер.
А) антитромбоцитарные антитела от матери к плоду – изоиммунная тромбоцитопения
Б) под влиянием лекарст, инфекции, изменение антигенной структуры – гетероиммунные
С) аутоиммунные болезнь Вертльгофа: тромбоцитопеническая пурпура, микроциркуляторный тип кровоточивости, болеют женщины, на передней поверхности туловища и конечностей множественные петехии и синички, которые возникают не одновременно, сливаясь кровоизлияния достигают блюдца, имея разный цвет такая кожа напоминает кожу леопарда. Кровотечения из слизистых оболочек, м.б. профузные носовые кровотечения. Опасны операции с небольшими разрезами, длительные метро- и меноррагии. Кровавый пот и слезы.ушные кровотечения.
Патогенез кровоточивости:
из-за отсутствия тромбоцитарной тромбокиназы нарушается 1 фаза
нарушение ретракции сгустка
повышена проницаемость сосудов – петехии
падение тонуса, ломкость сосудов – петехии
симптоматические тромбоцитопении:
спленомегалия
болезни кроветворной системы
лучевая болезнь
инфекции и интоксикация
портальная гипертензия
гипертромбоцитоз: может быть до 1000*109/л. Синдром гиперкоагуляции – ДВС –синдром.
3 группа: обусловленные поражением сосудистой стенки:
геморрагии, микротромбоваскулит (болезнь Шейнлян-Геноха)
иммунокомплексной природы, провоцируется острыми инфекционными заболеваниями, прививками, лекарствами. Из-за воспаления иммунного сосудистой стенки возникают вторичный ДВС-синдром, но при этом возникновение тромбов неодновременно и имеет очаговый характер.
пурпура симплекс: после воздействия факторов увеличивается проницаемость сосудистой стенки и на коже появляются трансэкссудативные высыпания (папулы, везикулы). Через сутки они приобретают геморрагический характер. Имеет место явления острофазового ответа.через 2 недели все бесследно исчезает.
пурпура ревматика (кожно-суставная): высыпания и на коже и на синовиальной оболочке суставах. В центре высыпаний появляются некрозы. Через несколько недель все исчезает бесследно.
пурпура абдоминалис: высыпания на слизистых кишечника, а затем к ним присоединяются воспаление – кровавый стул, рвота, клиника острого живолта. Если возникает гематома в слизистой кишечника, тогда это приводит к инвагинации и непроходимости (самоизличение). У ¼ больных геморрагические гломерулонефриты – ОПН и ХПН.
пурпура фульминанс (молниеносная): одновременно проявления всех форм выраженные в макси. Кожногеморргические высыпания на теле, слизистых, образующие сплошную геморрагическую поверхность с некрозами. Кровоизлияния в суставы, абдоминальная форма. На 2-3 день субарахноидальные кровоизлияния.
4 группа: сочетанные поражения:
1) ангиогемофилии –болезнь Виллебранта: наследуется аутосомнодоминантно. При этом в крови снижается или отсутствует минорный белок фактор Виллебранта, он сохраняет активность 8 фактора свертывающей системы и образует мостики между тромбоцитами и эндотелием (фаза адгезии). При его отсутствии микрососуды утрачивают свой тонус и возникают кровотечения. Из-за снижения активности тромбоцитов возникает микроциркуляторный тип кровоточивости и одновременно обильные профузные кровотечения из слизистых оболочек. Но из-за 8 фактора возникает гематомный тип кровоточивости – подкожные гематомы. Поэтому имеет место гематомно-микроциркуляторный тип кровоточивости – опасны небольшие разрезы (длительные кровотечения), опасны для женщин – метро- и меноррагии из-за патологической дилятации капилляров.
2) ДВС –синдром:
причины:
наследственный или приобретенный дефицит антикоагулянтов
активация свертывающей системы – обычно залповый выброс тканевых тромбокиназ при травмах, разможжение тканей, ожоги, шок
поражение сосудистой стенки и гиперлипидемия
внутрисосудистый гемолиз
стадии ДВС – синдрома:
гиперкоагуляция –
может быть обширная окклюзия микрососудов тромбами, происходит блокада системы микроциркуляции – снижение венозного возврата – шок – смерть
может быть локальная блокада: вначале закрытие капилляров, затем вен, что способствует сипмтомам недостаточности тех органов: церебральной, коронарной, почечной ит.д. резкое ухудшение кровоснабжения и развитие дистрофических и некротических процессов в тканях и приобретает необратимый характер.
коагулопатия потребления: при множественных тромбах расходуются прокоагулянты и это приводит к снижению активности свертывающей системы. Во множественных тромбах происходит расщепление фибрина и резко активируется противосвертывающая система – диффузная кровоточивость.
активация фибринолиза
восстановительная стадия: восстановление дефекта тканей.
studfiles.net










