Какие методы лечения ревматоидного артрита применяют современные ревматологи. Базисная терапия при ревматоидном артрите
Лечение ревматоидного артрита препаратами нового поколения
Лечение ревматоидного артрита препаратами нового поколения помогает улучшить состояние больных людей и предотвратить их раннюю инвалидизацию. При отсутствии своевременной терапии потеря трудоспособности может наступить уже через 5 лет после появления первых признаков патологии. Хроническое заболевание вызывает разрушение суставного хряща и кости. Оно сопровождается аутоиммунными нарушениями и приводит к развитию системных воспалительных процессов. Ревматоидный артрит не только существенно ухудшает качество жизни людей, но и укорачивает их жизнь.
Базисная терапия ревматоидного артрита
Лечение ревматоидного артрита проводится с помощью базисных противовоспалительных препаратов (БПВП). Они являются главным элементом медикаментозной терапии недуга и назначаются каждому пациенту при отсутствии у него противопоказаний. БПВП помогают быстро купировать симптомы активного ревматоидного артрита, кроме того, остановить разрушительные процессы в суставных и околосуставных тканях.
Базисные препараты для лечения ревматоидного артрита часто назначают на самой ранней его стадии, когда имеется в запасе период перед проявлением яркой симптоматики («терапевтическое окно»). Их рекомендуют даже до уточнения диагноза. Базисная терапия поможет предотвратить возникновение серьезной деформации суставов, сердечно-сосудистых патологий и остеопоротических переломов.
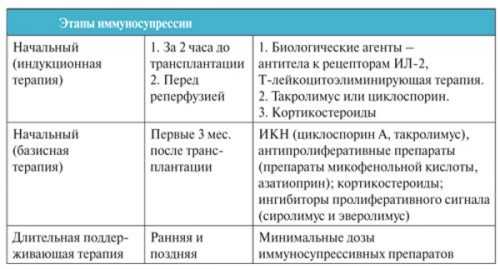
Базисные лекарственные средства относятся к иммуносупрессорам. Медикаментозная иммуносупрессия (подавление иммунитета) является основой лечения ревматоидного артрита. Чтобы добиться существенного улучшения состояния больного артритом и замедлить прогрессирование патологических процессов, иммуносупрессивная терапия должна быть дифференцированной, длительной и непрерывной.
Базовое лекарственное средство Метотрексат
Золотым стандартом лечения ревматоидного артрита является Метотрексат. Медикаментозное средство, направленное на торможение и угнетение процессов патологического деления и роста соединительных тканей (цитостатик), относится к группе антиметаболитов, антагонистов фолиевой кислоты. Оно тормозит деление клеток, угнетает синтез и функцию восстановления ДНК, кроме того, в меньшей мере влияет на выработку РНК и белка.
Метотрексат оказывает выраженное иммуносупрессивное действие даже при относительно малых дозировках. Приблизительно у 70% больных ревматоидным артритом, использующих Метотрексат, со временем появляется стойкая ремиссия заболевания.
Препарат хорошо переносится больными. Они редко жалуются на негативные проявления. Пятая часть пациентов сталкивается с кожными высыпаниями, расстройством стула, затруднениями при мочеиспускании и «бегающими мурашками». При назначении Метотрексата осуществляется клинико-лабораторный мониторинг, позволяющий выявить сбои в работе почек, печени и в системе кроветворения на ранней стадии. При обнаружении негативных изменений, дозировка корректируется.
Метотрексат принимается внутрь еженедельно одномоментно или в 3–4 приема с интервалом в 12 часов. Если у больного появляются жалобы на проблемы с пищеварением, базовый препарат может быть назначен внутривенно или внутримышечно. Каждые 2–4 недели дозировку увеличивают, добиваясь нужного клинического результата. Уже через 1–1,5 месяца больной ощущает значительное улучшение самочувствия.
В день, когда пациент принимает Метотрексат, использование нестероидных противовоспалительных препаратов (НПВП) не допускается.
Препарат базовой терапии Лефлуномид (Арава)
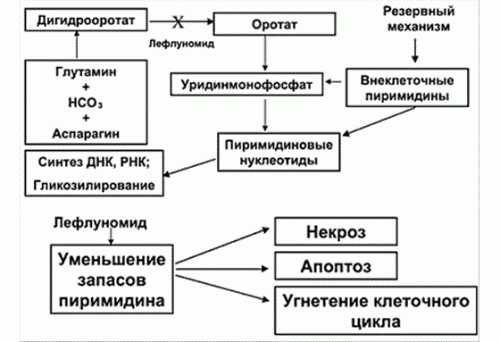
 Препарат Арава разработан специально для лечения ревматоидного артрита. Он подавляет выработку фермента дегидрооротатдегидрогеназы, который принимает участие в синтезе уридинмонофосфата. Угнетение производства пиримидиновых нуклеотидов приводит к изменению аутоиммунного ответа. Сдерживая развитие ревматоидного артрита, Лефлуномид не оказывает влияния на фагоцитоз человека. Он эффективен на ранней и на поздней стадии недуга. Противовоспалительное действие развивается уже после 30 дней его применения. В среднем облегчение самочувствия больного возникает на 9 неделе терапии.
Препарат Арава разработан специально для лечения ревматоидного артрита. Он подавляет выработку фермента дегидрооротатдегидрогеназы, который принимает участие в синтезе уридинмонофосфата. Угнетение производства пиримидиновых нуклеотидов приводит к изменению аутоиммунного ответа. Сдерживая развитие ревматоидного артрита, Лефлуномид не оказывает влияния на фагоцитоз человека. Он эффективен на ранней и на поздней стадии недуга. Противовоспалительное действие развивается уже после 30 дней его применения. В среднем облегчение самочувствия больного возникает на 9 неделе терапии.
После 6 месяцев терапии наблюдается снижение темпов прогрессирования ревматоидного артрита. Количество новых эрозий в суставах стоп и кистей значительно снижается. Припухлость суставов и их болезненность становятся менее выраженными. Достигнутый результат сохраняется длительное время. Проведенными исследованиями подтверждена высокая эффективность лекарства через 3 года после начала его использования.
Благоприятный результат от терапии Лефлуномидом отмечается в 94% случаев. Арава демонстрирует более высокую эффективность, по сравнению с «золотым стандартом» терапии — Метотрексатом. Подобный результат развивается только после 1 года использования Метотрексата.
Препарат Арава назначается по стандартной схеме. В течение первых 3 суток применяется максимальная доза, затем количество препарата уменьшают. Если существует вероятность непереносимости лекарственного средства, начальную дозу снижают. Лефлуномид воспринимают больные лучше, чем Метотрексат.
Лечение ревматоидного артрита золотом
Базисная терапия патологии может осуществляться солями золота. Ауротерапия дает хорошие результаты на начальном этапе развития недуга. Она показана людям, у которых патология развивается стремительно. Препараты золота назначают людям, страдающим от мучительных болей в суставах и многочасовой утренней скованности. Они помогут в тех случаях, когда другие обезболивающие лекарства не оказывают желаемого воздействия.
 Рекомендуется ауротерапия при серопозитивном ревматоидном артрите. У таких больных существенно замедляются разрушительные процессы в хрящевой ткани. Приостанавливается формирование костных кист и эрозий. Соли золота улучшают минерализацию костей. Известны случаи исчезновения костных эрозий внутри костей пораженных сочленений стоп и кистей.
Рекомендуется ауротерапия при серопозитивном ревматоидном артрите. У таких больных существенно замедляются разрушительные процессы в хрящевой ткани. Приостанавливается формирование костных кист и эрозий. Соли золота улучшают минерализацию костей. Известны случаи исчезновения костных эрозий внутри костей пораженных сочленений стоп и кистей.
Ауротерапия помогает вылечить ювенильный ревматоидный артрит. Она позволяет облегчить состояние людей, у которых диагностированы серьезные осложнения ревматоидного артрита — синдром Фелти или синдром Шегрена. В последнем случае соли золота помогут справиться только с симптомами заболевания.
Соли золота можно использовать при сопутствующих заболеваниях, в том числе инфекционных и онкологических. Они дополнительно оказывают антибактериальный и противогрибковый эффект. Ожидаемый результат становится заметным через 2–3 месяца. Если спустя полгода после начала приема солей золота нет позитивных изменений, лечение необходимо прекратить в виду его нецелесообразности.
Наибольший лечебный эффект достигается при употреблении количества лекарств, в сумме содержащих менее 1 грамма золота. После достижения этого предела лечение считается малоэффективным. Если позднее ревматоидный артрит повторно обострится, ауротерапия больному не поможет.
Побочные реакции ауротерапии
Выраженное улучшение состояния больных сочленений нередко сопровождается проявлением побочных реакций. Пациенты обнаруживают сыпь в виде розовых пятнышек и небольших пузырьков, интенсивно зудящих. Симптомы кожных реакций проявляются сильнее под лучами солнца. Кожа может приобрести бронзовый тон. Иногда соли золота откладываются, образуя на коже пятна лилового цвета. Дерматологические реакции, возникающие при ауротерапии, часто ошибочно принимают за экзему. При длительном применении солей золота может возникнуть некроз участков кожи.
При ревматоидном артрите препараты золота могут спровоцировать нефропатию. С целью недопущения осложнения во время ауротерапии осуществляют контроль за показателями мочи больного. На фоне лечения солями золота могут воспаляться слизистые оболочки.
Глюкокортикостероиды, НПВП и сульфаниламиды
В качестве иммуносупрессоров при лечении ревматоидного артрита используют глюкокортикостероиды. Они также обладают противовоспалительным действием, которое может развиться в течение 2–3 часов после внутрисуставного введения. При длительном лечении низкими дозами глюкокортикостероидов наблюдается угнетение эрозивного процесса в костях, подвижность суставов улучшается.
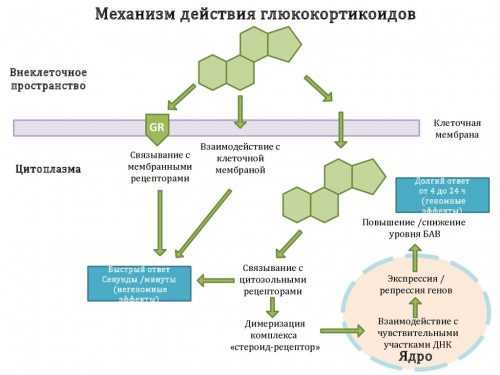
У пациентов на ранней стадии заболевания и с доклиническими проявлениями патологии обнаруживают функциональную недостаточность гипоталамуса, гипофиза и надпочечников. Поэтому гормональная терапия низкими дозами препаратов является заместительной, направленной на коррекцию деятельности органов эндокринной системы.
Ревматический недуг лечат:
- Преднизолоном;
- Триамцинололом;
- Дексаметазоном;
- Метилпреднизолоном;
- Бетаметазоном.
Гормональные препараты применяют системно (внутрь) или локально (внутрисуставные инъекции). Из-за негативного влияния на организм их используют кратковременно при тяжелых состояниях больных.
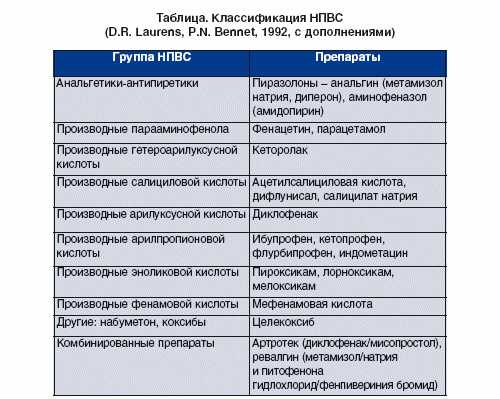
В качестве экстренной помощи при сильном болевом синдроме используют нестероидный противовоспалительный препарат. Новое поколение НПВП вызывает гораздо меньше побочных эффектов. Их действие обусловлено выборочным блокированием только одной изоформы фермента циклооксигеназы (ЦОГ-2), которая контролирует выработку медиаторов боли — простагландинов. Селективные НПВП легко переносятся больными и редко вызывают заболевания желудочно-кишечного тракта.
Список НПВП нового поколения содержит 2 вида медикаментозных средств — преимущественно селективные и высокоселективные. При лечении ревматоидного артрита часто отдают предпочтение первому виду (Нимесулид, Мовалис). При сильной боли концентрация ЦОГ-1 увеличивается в 4 раза. Поэтому для достижения анальгетического эффекта лучше использовать НПВП, которые блокируют обе изоформы ЦОГ-1 и ЦОГ-2.
 В базовую терапию также включают Сульфасалазин — препарат из группы сульфаниламидов. Он не уступает по эффективности другим БПВП, когда назначается для лечения ревматоидного артрита с низкой скоростью прогрессирования. Сульфаниламиды хорошо переносятся и не вызывают тяжелых осложнений. Терапию начинают с минимальной дозы, постепенно увеличивая ее в течение месяца. Ожидаемый результат проявляется через 6-10 недель.
В базовую терапию также включают Сульфасалазин — препарат из группы сульфаниламидов. Он не уступает по эффективности другим БПВП, когда назначается для лечения ревматоидного артрита с низкой скоростью прогрессирования. Сульфаниламиды хорошо переносятся и не вызывают тяжелых осложнений. Терапию начинают с минимальной дозы, постепенно увеличивая ее в течение месяца. Ожидаемый результат проявляется через 6-10 недель.
Терапия патологии биологическими препаратами
В последнее время все чаще используются биологические препараты для лечения ревматоидного артрита. Они назначаются пациентам, у которых наблюдается тяжелое протекание ревматоидного артрита с неблагоприятным прогнозом и неуклонным прогрессированием (более пяти деформированных и воспаленных суставов).
Биологические препараты отличаются от базисных лекарственных средств быстрым действием. С их помощью можно добиться выраженного облегчения состояния больного через 7–14 дней после первого приема лекарства. Иногда интенсивность симптомов резко снижается уже через несколько дней. По степени воздействия на организм биологические средства можно сравнить с препаратами интенсивной терапии.
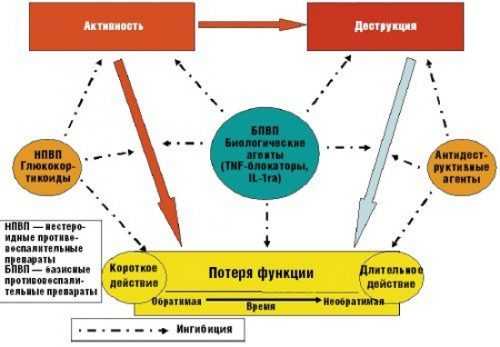
Биологические лекарства часто используют вместе с базовыми. Они усиливают благоприятное воздействие друг друга. Эта особенность сильнее всего проявляется в комбинации с Метотрексатом.
Термин «биологические препараты» относят к медикаментозным средствам, изготовленным с помощью генной инженерии. Они характеризуются более точным выборочным действием на ключевые моменты реакции воспаления по сравнению с базовыми лекарствами. Терапевтический эффект достигается посредством влияния на молекулы — мишени, отвечающие за иммунное воспаление.
Создание генно-инженерных биологических препаратов (ГИБП) является одним из наиболее значимых достижений современной фармакотерапии. Применение ГИБП позволяет существенно уменьшить активность иммуннопатологического процесса и быстро добиться желаемого клинического результата. С их помощью удается улучшить качество жизни больных. ГИБП позволяют замедлить прогрессирование поражения суставов даже у пациентов, которым не помогла базисная терапия.
Недостатком биологических препаратов является способность угнетать противоинфекционный и противоопухолевый иммунитет. Поскольку биологическое лекарство является белком, существует высокая вероятность появления аллергических реакций.
Биологический препарат Инфликсимаб (Ремикейд)
Наиболее популярным ГИБП от ревматоидного артрита является Инфликсимаб (Ремикейд). Он связывается с ФНО-альфа, образуя устойчивое соединение. Белок ФНО-a участвует во многих противоспалительных реакциях. После применения Инфликсимаба уменьшение суставной щели происходит медленнее, эрозивный процесс затухает.
Перед терапией Инфликсимабом необходимо провести обследование пациента с целью выявления туберкулеза. Начальная доза препарата вводится внутривенно капельно. Последующие дозы Инфликсимаба вводят через 2 и 6 недель, затем — каждые 8 недель. Если терапевтический эффект не достигнут, дозировка может быть увеличена. Минимальный курс лечения обычно составляет 1 год. После отмены биологического средства, продолжают лечить заболевание базовыми препаратами.
Во время лечения биологическими препаратами и на протяжении полугода после их отмены женщинам необходимо пользоваться надежными противозачаточными средствами. Инфликсимаб оказывает патологическое воздействие на иммунную систему развивающегося плода.
ortocure.ru
Базисная терапия ревматоидного артрита назначается всем пациентам
Ревматоидный артрит — весьма непростое заболевание, он требует длительного, многолетнего лечения, которое в состоянии лишь замедлить разрушительные процессы в организме. Поскольку многие пациенты уже в первые 5 лет после дебюта заболевания становятся инвалидами, медицинская наука активно изучает это заболевание, ученые всего мира пытаются найти пути его лечения.
Принципы лечения ревматоидного артрита
- Информирование больного о характере заболевания и возможных прогнозах,
- Всё лечение проходит под контролем ревматолога,
- Обязателен мониторинг активности болезни.
Лечение назначается в соответствии с процессами, протекающими в организме из-за болезни. Причиной являются аутоиммунные нарушения, а основные проявления — это системные воспалительные процессы, сопровождающиеся разрушением суставных хрящей и кости.
Основные цели лечения ревматоидного артрита:
- Купирование симптомов,
- Замедление прогресса заболевания,
- Достижение ремиссии или сведение к минимуму активности болезни,
- Сохранение трудоспособности, улучшение качества жизни.
Лечение включает:
- Медикаментозную терапию (противовоспалительные и иммуноподавляющие препараты),
- Немедикаментозную терапию (физиопроцедуры, диета и другое),
- Ортопедическое лечение, реабилитацию (коррекция суставов, лечебная физкультура, санаторно-курортное лечение).
Основное лечение — медикаментозное. Оно включает в себя два уровня:
- Базисные противовоспалительные препараты,
- Нестероидные противовоспалительные препараты и глюкокортикостероиды.
Базисные противовоспалительные препараты — это те средства, которые обязательно назначаются всем больным ревматоидным артритом.
Базисная терапия ревматоидного артрита
Базисные средства должны быть назначены как можно раньше, чтобы достичь наилучших из возможных результатов. Обычно их назначают сразу после постановки диагноза. Если этого не сделать в течение нескольких месяцев после появления симптомов, то возможны массивные разрушительные процессы, которые крайне негативно сказываются на состоянии больного и его качестве жизни.
Свойства базисных препаратов:
- Иммунодепрессия, сопровождающаяся снижением активности болезни,
- Стойкость клинического эффекта,
- Способность задерживать процесс разрушения суставов,
- Возможность вызвать ремиссию заболевания,
- Медленное проявление клинически значимого эффекта (1-3 месяца).
Приблизительно у 60% пациентов наблюдается значительное улучшение состояния в ответ на базисную терапию ревматоидного артрита. Препараты назначаются на срок от полугода, так как нужно время для достижения эффекта. Общая длительность лечения определяется индивидуально. Она может составлять несколько лет или даже десятков лет. Как правило, лечение одним препаратом продолжается 2-3 года, потом может быть назначен другой. В зависимости от ответа организма на лечение назначается дозировка препарата. Возможен прием поддерживающих доз, которые помогают пациенту сохранить достигнутые улучшения.
Базисные противовоспалительные препараты различаются между собой по механизму действия, поэтому при их назначении учитывают особенности пациента и заболевания в каждом конкретном случае.
Базисные препараты для лечения ревматоидного артрита
 Данные лекарства условно подразделяют на препараты первого и второго ряда. Средства первого ряда назначаются большинству пациентов, так как обладают лучшей эффективностью и переносимостью. Они успешно подавляют прогрессирование эрозивного процесса в суставах. Препараты второго ряда назначают при неэффективности средств первого ряда или при плохой их переносимости.
Данные лекарства условно подразделяют на препараты первого и второго ряда. Средства первого ряда назначаются большинству пациентов, так как обладают лучшей эффективностью и переносимостью. Они успешно подавляют прогрессирование эрозивного процесса в суставах. Препараты второго ряда назначают при неэффективности средств первого ряда или при плохой их переносимости.
Для базисной терапии может быть назначено лечение одним препаратом или комбинированное лечение. Некоторые клинические исследования говорят о более высокой эффективности комбинированной терапии, но и риск побочных эффектов при этом возрастает.
Какие препараты чаще всего используют для базисной терапии ревматоидного артрита?
- Соли золота,
- Антималярийные средства,
- Иммуноподавляющие препараты,
- Сульфасалазин,
- Пеницилламин.
Самая популярная группа препаратов — препараты золота (кризанол, ауранофин). Большинству пациентов эти средства приносят значительное облегчение. Однако следует учитывать и возможные осложнения и побочные эффекты: воспаление слизистой рта, аллергическая сыпь, угнетение кроветворения и деятельности почек.
Антималярийные препараты способны влиять на активность ревматоидного процесса. Для лечения ревматоидного артрита используют делагил и плаквенил. Эти препараты принимают очень длительно, потому что действуют они медленно. Однако во многих случаях оказываются эффективными. Особенно актуальны антималярийные средства, когда при применении других базисных препаратов наблюдается побочное действие или неэффективность.
 Пеницилламин (купренил) по эффективности не уступает препаратам золота, однако он очень токсичен и часто вызывает осложнения. Поэтому назначают его в тех случаях, когда другие средства не помогают. Пеницилламин противопоказан при беременности и заболеваниях крови и почек. При его приеме нужно регулярно контролировать состав крови, дважды в месяц нужно сдавать анализ мочи, чтобы не пропустить негативные изменения в организме. В случае неблагополучия препарат отменяют, и все его побочные эффекты со временем проходят.
Пеницилламин (купренил) по эффективности не уступает препаратам золота, однако он очень токсичен и часто вызывает осложнения. Поэтому назначают его в тех случаях, когда другие средства не помогают. Пеницилламин противопоказан при беременности и заболеваниях крови и почек. При его приеме нужно регулярно контролировать состав крови, дважды в месяц нужно сдавать анализ мочи, чтобы не пропустить негативные изменения в организме. В случае неблагополучия препарат отменяют, и все его побочные эффекты со временем проходят.
Сульфасалазин — антимикробный препарат, успешно применяемый для базисной терапии ревматоидного артрита. Эффективность его несколько слабее, чем препаратов, описанных выше, однако он хорошо переносится больными, редко дает побочные эффекты. Осложнения от приема препарата никогда не бывают тяжелыми. Чаще всего это сыпь на коже и расстройство стула.
Иммунодепрессанты, которые применяют при ревматоидном артрите (метотрексат, циклофосфан, азатиоприн, хлорбутин, лейкеран), относятся к цитостатическим препаратам. Эти же средства используют при лечении онкологии, только в значительно больших дозах. Цитостатики способны помочь больным даже с быстро прогрессирующей тяжелой формой ревматоидного артрита. Эффект ощущается уже через 2-4 недели после начала приема препаратов. Побочные действия возникают в 15-20% случаев. Это могут быть сыпь, расстройство стула и мочеиспускания, ощущение «мурашек» на теле.
Результаты лечения
Лечение базисными препаратами помогает пациенту дольше оставаться, что называется, в строю, приносит значительное облегчение состояния. Снимаются болезненные ощущения, в большинстве случаев удается достичь замедления процессов эрозии суставов и приостановить системные процессы в организме. Однако, к сожалению, излечения от ревматоидного артрита пока достичь не удается.
tvoyaybolit.ru
Базисная терапия ревматоидного артрита (ренесcанс гидроксихлорохина в схемах лечения)
Резюме. В обзоре дано обоснование применения гидроксихлорохина в лечении пациентов с ревматоидным артритом. Описаны схемы базисной терапии с включением данного препарата.
Противовоспалительный эффект антималярийных препаратов отмечен почти 200 лет назад. Хинин и цинхонин, активные компоненты хинного дерева, были выделены еще в 1820 г. В конце XIX в. английский врач J.P. Payne впервые выявил клинический эффект хинина при красной волчанке. В последующем два синтетических аминохинолиновых аналога — хлорохин дифосфат и гидроксихлорохин сульфат (Гх) — стали широко применять в ревматологии. Отмечено, что при их примерно одинаковой эффективности хлорохин приблизительно в 2–3 раза токсичнее, чем Гх (VcChesney E.W., 1983).
Гх имеет разнообразные механизмы действия. В лечении пациентов с ревматическими заболеваниями наиболее значимыми являются противовоспалительное, анальгезивное и иммуномодулирующее его влияние (Fox R.I., 1993). Кроме того, Гх вызывает гипогликемический, гиполипидемический, антиагрегантный, антиоксидантный, антимикробный и антипролиферативный эффект, что имеет общетерапевтическое значение.
Среди базисных противовоспалительных препаратов (БПВП), применяемых в лечении пациентов с ревматоидным артритом (РА), Гх занимает особое место. Это связано с тем, что его положительный эффект у больных РА в сравнении с плацебо становится достоверным при длительном лечении (не менее 6 мес), при этом эффективность различных доз препарата примерно одинакова (Насонов Е.Л., 1996). В 60–70-е годы ХХ ст. до широкого внедрения в практику концепции раннего «агрессивного» лечения РА антималярийные препараты назначались в дебюте болезни подавляющему большинству пациентов. Следует отметить, что при высокоактивных вариантах начала РА аминохинолиновые препараты не позволяли достичь выраженного эффекта в течение нескольких месяцев ни в отношении клинических проявлений РА, ни в отношении рентгенологического прогрессирования болезни. Тем не менее, результы анализа течения РА в большой группе больных (>600 пациентов) свидетельствуют, что применение аминохинолиновых препаратов в самые ранние сроки болезни (до 6 мес), даже при их недостаточной эффективности и необходимости замены на другие БПВП на этапах лечения и наблюдения, все же ассоциировалось с более благоприятным исходом через 15–20 лет болезни по сравнению с пациентами, которым БПВП были назначены через 1–3 года болезни (Чичасова Н.В., Насонов Е.Л., 2004).
На современном этапе лечение РА ориентировано на как можно более быстрое подавление активности болезни, что приводит к снижению прогрессирования деструкции в суставах и сохранению функциональной способности больных (Emery P., 1995). Наличие в настоящее время достаточного спектра БПВП, эффект которых развивается гораздо быстрее, в течение 1–3 мес (метотрексат, лефлуномид, алкилирующие цитостатики), делают их раннее назначение у больных активным РА более обоснованным. Согласно современным рекомендациям (Combe B. et al., 2007) препаратами первой линии среди БПВП при РА признаны метотрексат и лефлуномид, а Гх стал назначаться гораздо реже. Представляется, что существует несколько ситуаций, когда применение Гх может быть полезным.
В дебюте развития суставного синдрома не у всех больных возможна точная нозологическая верификация диагноза. И РА, и диффузные болезни соединительной ткани (ДБСТ) могут дебютировать с одинаковых симптомов — симметричного полиартрита с небольшой утренней скованностью, отсутствием достоверных лабораторных маркеров (ревматоидного фактора, антинуклеарного фактора и др.). В этой ситуации Гх может быть препаратом выбора, поскольку он успешно применяется и в лечении ДБСТ. Известно, что Гх способен подавлять синтез цитокинов (интерлейкина (ИЛ)-1, ИЛ-6, фактора некроза опухоли (ФНО)-α), ингибировать разрушение хряща, индуцированного ИЛ-1, подавлять синтез интерферона-γ активированными Т-лимфоцитами, что в определенной степени будет модифицировать активность воспалительного процесса (Picot S., 1991; Landrewe R.B.M. et al., 1994) в период уточнения диагноза болезни. При этом у Гх отсутствуют противопоказания к назначению его при других болезнях, протекающих с развитием суставного синдрома (в том числе и пара-, постинфекционных).
Течение РА весьма вариабельно. Это связано со многими причинами. Прежде всего, в дебюте заболевания установление точного диагноза не всегда возможно. Диагностические критерии, предложенные Американским колледжем ревматологов (ACR) в 1987 г., не соответствуют требованиям ранней диагностики РА. Поэтому в последние годы совместными усилиями Европейской антиревматической лиги (EULAR) и ACR разрабатываются новые критерии, ориентированные на как можно более раннее установление диагноза РА. Известно, что воспаление в синовиальной оболочке может начать развиваться задолго до появления первых клинических симптомов заболевания.
В крови больных РА за несколько лет до дебюта артрита (вплоть до 10 лет) выявляют серологические тесты, такие как ревматоидный фактор (РФ) и/или антитела к циклическому цитрулинированному пептиду (АЦЦП) (Nielen M.M. et al., 2004). Морфологическое исследование синовиальной оболочки, полученной при биопсии у больных в первые месяцы после дебюта артрита, показало, что не у всех выявляются признаки острого ревматоидного воспаления, у большинства пациентов уже в первом биоптате отмечаются отчетливые признаки хронического синовита (Шехтер А.Б. и соавт., 1985). Таким образом, даже в дебюте развития суставного поражения болезнь может представлять хроническую стадию. Поэтому задержка с назначением терапии БПВП ухудшает отдаленный прогноз РА как функциональный, так и жизненный. Для новых диагностических критериев EULAR/ACR выбраны 4 группы параметров, а каждый параметр на основании многомерного статического анализа получил балльную выраженность, при сумме ≥6 баллов устанавливается определенный диагноз РА.
В группу лекарственных средств, замедляющих прогрессирование РА, входят хлорохин, гидроксихлорохин, сульфасалазин, метотрексат, препараты золота, пеницилламин и азатиоприн (Farr M., Bacon P.A., 1995; Насонов Е.Л., 2010). Лечение этими препаратами проводится под наблюдением ревматолога. Для своевременного выявления побочных эффектов необходимо регулярное обследование.
Средства, замедляющие прогрессирование РА, показаны при тяжелом, без ремиссий, течении заболевания и неэффективности нестероидных противовоспалительных препаратов. По современным представлениям эти препараты необходимо назначать уже на ранних стадиях заболевания (Paulus H.E., 1993; Насонов Е.Л., 1996).
Хлорохин и Гх. Наименее выраженные побочные эффекты среди всех препаратов, замедляющих прогрессирование РА, вызывает Гх. Он разрешен FDA к применению при РА. В дозе 5–7 мг/кг/сут (обычно 400 мг/сут) внутрь препарат вызывает ремиссию у 20% и улучшение — у 50% больных. Однако его действие развивается только через 3–6 мес. Гх можно назначать в сочетании с любым другим препаратом, замедляющим прогрессирование РА. Показано, что применение Гх позволяет снизить дозу кортикостероидов, а также уровень холестерина в сыворотке на 15–20%, угнетает адгезию и агрегацию тромбоцитов, но не увеличивает время кровотечения. Указанные эффекты Гх делают этот препарат особенно ценным при лечении больных, постоянно применяющих кортикостероиды. У 10% пациентов, принимающих Гх, отмечаются головная боль, тошнота, сыпь и гриппоподобный синдром, которые проходят вскоре после отмены препарата или снижения его дозы. Поскольку у 3% больных, принимавших препарат в течение 10 лет, развивается ретинопатия, каждые 6 мес пациента должен осматривать офтальмолог. На раннем этапе изменения сетчатки обратимы. При лечении Гх ретинопатия возникает гораздо чаще — у 10% больных, принимавших препарат не менее 10 лет, причем изменения сетчатки часто необратимы.
Сульфасалазин давно используют при РА, хотя в США он до сих пор не разрешен к применению при этом заболевании. Сульфасалазин и Гх наиболее безопасные средства, замедляющие прогрессирование РА, однако сульфасалазин оказывает побочное действие несколько чаще, чем Гх. Основное противопоказание к применению сульфасалазина — его непереносимость (Pincus T. et al., 1992).
Метотрексат — цитостатик, антагонист фолиевой кислоты — в настоящее время применяют чаще других средств, замедляющих прогрессирование РА (Сергиец Н.А., Еров Н.К., 2009). Побочные действия метотрексата делятся на ранние и отсроченные. К ранним относят желудочно-кишечные нарушения (25%), язвы слизистой оболочки рта (15%) и головную боль (10%) в течение нескольких суток после применения препарата. Риск возникновения этих побочных действий можно уменьшить, снизив дозу или назначив препарат парентерально. Отсроченные побочные действия отмечают у 10–30% больных. Это анемия, лейкопения или тромбоцитопения, быстро проходящие после снижения дозы метотрексата. У <1% больных развивается лекарственный пневмонит — тяжелое осложнение лечения метотрексатом, которое может угрожать жизни больного. Изредкa наблюдается оппортунистическая инфекция (грибковая, пневмоцистная и др.). Часто повышается активность аспартатаминотрансферазы (АсАТ) и аланинаминотрансферазы (АлAT) — она становится максимальной на 3-и сутки после применения препарата). Каждые 8–12 нед (а в первые 2 мес лечения — каждые 2 нед) проводят общий анализ крови и определяют активность печеночных ферментов. Если активность АсАТ и АлAT >100 Ед/л, препарат отменяют. Лечение возобновляют через несколько недель, при этом препарат назначают в более низкой дозе.
Препараты золота — уротиомалат натрия, ауротиоглюкоза и аурофин. Побочные действия — сыпь, стоматит, угнетение кроветворения (тромбоцитопения, а затем — лейкопения и анемия), поражение почек (первое проявление — протеинурия). Угнетение кроветворения и нефротоксическое действие — показание к отмене препаратов золота.
Пеницилламин выпускают в таблетках и капсулах. Действие препарата развивается лишь через несколько месяцев после начала лечения. Побочные действия наблюдаются часто. У ⅓ больных препарат неэффективен.
Азатиоприн — иммунодепресант, структурный аналог пурина. Разрешен FDA к применению при РА, однако у 20% больных отмечаются желудочно-кишечные нарушения, у 15% — изменение биохимических показателей функции печени, изредка — панцитопения. Азатиоприн повышает риск развития гемобластоза, поэтому длительно его не назначают (при применении препарата в течение 20 лет гемобластоз возникает у 10% больных).
В последние годы комбинацию средств, замедляющих прогрессирование РА, рекомендовано начинать с высоких доз, а затем переходить на поддерживающие. Для оценки эффективности этой схемы лечения необходимы дальнейшие исследования (Saag K.G. et al., 2008).
В соответствии с рекомендациями Ассоциации ревматологов Украины основной группой препаратов для лечения РА (категория доказательности А) являются метотрексат и другие широко назначаемые препараты — лефлуномид и сульфасалазин, БПВП следует назначать как можно раньше (в пределах 3–6 мес от первого появления симптомов). В рекомендациях EULAR (2007) (Combe B. et al., 2007) указывается, что при риске развития персистирующего эрозивного артрита, даже если больной не соответствует классификационным критериям РА, показано назначение БПВП. Первым следует назначать метотрексат, а при невозможности его применения препаратами первой линии считают лефлуномид, сульфасалазин и соли золота (Имаметдинова Г.Р., 1998). Согласно рекомендациям ACR (2008) (Saag K.G. et al., 2008) БПВП необходимо назначать как можно раньше после дебюта симптомов артрита, препаратами первой линии считают метотрексат и лефлуномид.
Далее во всех современных рекомендациях обращается внимание на то, что тактика лечения больного РА зависит от адекватности (или неадекватности) терапии. Таким образом, перед клиницистом стоят три задачи: выбор препарата, оценка адекватности терапии на ее этапах и своевременная коррекция лечения.
Последние рекомендации ACR (2008) (Saag K.G. et al., 2008) по лечению больных РА БПВП и генно-инженерными биологическими препаратами (ГИБП) включают определение основных параметров, которые следует учитывать при назначении препаратов. К ним относят: длительность РА, которая подразделяется на ранний РА (длительность болезни <6 мес), средняя длительность болезни (6–24 мес) и устоявшийся (длительный) РА при длительности симптомов >24 мес.
Наличие прогностически неблагоприятных признаков: активная болезнь (большое количество болезненных и припухших суставов), наличие эрозий на ранней стадии, повышение РФ и/или АЦЦП (Goecor-Ruiterman Y.P. et al., 2005), повышение СОЭ и/или С-реактивного белка (СРБ). Плохой прогноз при РА означает рентгенологическое прогрессирование деструкции суставов, утрату функции и повышение смертности, а также риска необходимости проведения хирургических операций на суставах.
В соответствии с рекомендациями ACR (2008) (Saag K.G. et al., 2008) лечение БПВП проводится в виде монотерапии или двойных и тройных комбинаций в зависимости от длительности терапии и наличия факторов неблагоприятного прогноза.
Метотрексат и лефлуномид — БПВП первой линии для монотерапии — назначают при любой длительности и любой активности, при наличии прогностически неблагоприятных признаков (Kalden J.R. et al., 2003).
Гх — назначают больным без признаков неблагоприятного прогноза и при длительности РА ≤4 мес.
Сульфасалазин — назначают при любой активности РА больным без наличия прогностически неблагоприятных признаков либо при умеренной активности РА с отсутствием признаков плохого прогноза.
Рекомендации ACR в отношении места комбинированного лечения 2–3 БПВП базируются на данных нескольких рандомизированных клинических исследований, в которых комбинация БПВП была более эффективна, чем монотерапия (исследования COBRA, BeST и др.) (Kalden J.R. et al., 2003; Goecor-Ruiterman Y.P. et al., 2005).
В клинической практике в качестве эффективных схем лечения предлагаются следующие комбинации БПВП.
Двойная комбинация БПВП — используется при высокой активности РА у больных с наличием признаков неблагоприятного прогноза. Комбинация метотрексата и гидроксихлорохина рекомендуется при большой длительности РА и низкой активности (уровень доказательности С). Комбинацию метотрексата и лефлуномида рекомендуется назначать при средней длительности (>6 мес) и наличии факторов неблагоприятного прогноза и проводить терапию так долго, как долго будет сохраняться высокая активность. Метотрексат в комбинации с сульфасалазином предлагается назначать при любой длительности РА, высокой активности, наличии признаков плохого прогноза (уровень доказательности А для длительности РА <6 мес и >24 мес; уровень доказательности С — для средней длительности РА). Комбинация сульфасалазина и Гх в соответствии с этими рекомендациями используется только в одной ситуации: средняя длительность РА (6–24 мес) с высокой активностью, но без наличия признаков плохого прогноза.
Тройная комбинация БПВП — метотрексат + гидроксихлорохин + сульфасалазин — назначается при наличии факторов неблагоприятного прогноза и при умеренной/высокой активности заболевания независимо от длительности болезни.
Другие БПВП являются препаратами второй и третьей линии и применяются при неэффективности или непереносимости этих четырех БПВП.
Рекомендации EULAR (2010) несколько отличаются от рекомендаций ACR (2008).
Как только больному устанавливают диагноз РА, ему сразу необходимо назначить лечение синтетическим БПВП.
Цель лечения: как можно более быстрое достижение ремиссии или низкой активности болезни у каждого пациента; если эта цель не достигается, необходим подбор терапии путем частого и непосредственного мониторинга (каждые 1–3 мес).
Первый БПВП. Метотрексат должен быть частью первой стратегической схемы лечения у больных активным РА.
Альтернативные первые БПВП. В случае противопоказаний к назначению метотрексата (или его непереносимости) следующие БПВП необходимо обсуждать в качестве (первой) стратегии лечения: сульфасалазин, лефлуномид и соли золота (инъекции).
Монотерапия или комбинация. Для больных, ранее не получавших БПВП, рекомендуется монотерапия, а не комбинированная терапия синтетическими БПВП.
Cчитается, что начало лечения РА, тем более на ранней стадии болезни, должно начинаться с монотерапии. А дальнейшая тактика врача зависит от результата терапии. При лечении любым БПВП возможно несколько вариантов результата: 1) снижение активности РА до низкой или достижение ремиссии; 2) снижение активности без достижения низкого ее уровня; 3) минимальное улучшение или его отсутствие. Первый и третий вариант не вызывают трудностей: терапия продолжается без изменений (1-й вариант) и препарат отменяется (3-й вариант). Наибольшие сложности представляет 2-й вариант — то есть развитие частичного эффекта на лечение БПВП. В этой ситуации возможна как замена БПВП, если степень достигнутого улучшения параметров активности не превышает 40–50% или присоединение к БПВП при ≥50% улучшении другого лекарственного средства (БПВП или ГИБП).
Особый интерес в настоящее время вызывает вопрос о применении ≥2 БПВП при лечении РА. Предполагалось, что комбинация БПВП будет способствовать повышению эффективности, более быстрому началу терапевтического действия и снижению токсичности по сравнению с монотерапией базисным препаратом (Paulus H.E., 1993; Agrawal S. еt al., 2007). Кроме того, назначение второго БПВП может помочь снизить развитие резистентности к ранее назначенному БПВП. Известно, что для многих БПВП длительность непрерывного приема для 50% больных составляет 1–2 года. Исключением является метотрексат и лефлуномид: более половины пациентов, начавших лечение МТ и большинство начавших лечение лефлуномидом продолжают принимать их в течение 5 лет. По данным литературы следует, что для снижения частоты развития побочных эффектов в комбинации БПВП необходимо применять препараты с минимальной токсичностью и хорошей длительной переносимостью. С этой точки зрения Гх является препаратом, отвечающим требованиям комбинированного лечения РА. До сих пор нет однозначного мнения о последовательности назначения БПВП при комбинированном их применении. В настоящее время используются две стратегии комбинированного применения базисных средств: последовательный режим присоединения второго БПВП (стратегия «step up») и одновременное назначение БПВП с переходом на монотерапию при достижении эффекта (стратегия «step down»). В ряде контролируемых исследований показано, что стратегия лечения РА «step down» имеет преимущества перед использованием монотерапии БПВП на ранней стадии болезни (Goecor-Ruiterman Y.P. et al., 2005). Проблемой одновременного назначения препаратов является сложность оценки переносимости каждого из них при развитии неблагоприятных реакций.
Комбинация метотрексата и Гх представляется удачной по нескольким причинам:
1. Оба препарата обладают хорошей переносимостью, в том числе и в длительные сроки.
2. У препаратов различный механизм действия и различные сроки развития эффекта.
3. Препараты имеют различный спектр проявлений непереносимости.
4. Сочетанное применение метотрексата и Гх достоверно снижает частоту гепатотоксических эффектов метотрексата за счет гепатопротекторного действия Гх и его способности вызывать стабилизацию лизосомальных ферментов (Baker D.G. et al., 1984; Sperber K. еt al., 1993).
Российскими коллегами проведено сравнительное открытое исследование эффективности и переносимости метотрексата (10–12,5 мг/нед) и его комбинации с Гх (400 мг/сут) в сопоставимых группах пациентов с достоверным РА. Показано, что данная комбинация наиболее эффективна при низкой и умеренной степени активности РА (хороший эффект терапии достигнут у 67% больных) и наименее эффективна при далекозашедших стадиях (IIIб–IV) деструктивного процесса в суставах (p<0,01) (Сергиец Н.А., Еров Н.К., 2009). В целом эффективность монотерапии МТ и его комбинации с Гх в нашем исследовании была равнозначной в отношении параметров активности. В другом исследовании, сравнивавшем эффективность монотерапии МТ и его комбинации с Гх (Имаметдинова Г.Р., 1998), было показано, что комбинированная терапия приводила к более быстрому развитию хорошего эффекта, чем монотерапия метотрексатом через 75,0±25,1 дней и через 105,0±21,1 дней соответственно (p<0,05), а также к достоверно более частому развитию хорошего эффекта (p<0,01).
Наиболее интересным представляется оценка влияния комбинированной терапии на динамику эрозивного процесса в суставах.
Доказано, что комбинированная терапия оказывает большее сдерживающее влияние на прогрессирование деструкции в мелких суставах. Отмечено также, что при хорошем эффекте лечения прирост эрозий в обеих группах был равным (2,55±3,61 —при лечении метотрексатом и 2,77±4,62 — при использовании комбинации с Гх), а при удовлетворительном эффекте лечения увеличение количества эрозий было достоверно больше при монотерапии метотрексатом (10±5,33), чем при его комбинации с Гх (4,53±5,46) (р<0,01).
В реальной клинической практике чаще используется стратегия постепенного присоединения второго базисного препарата при недостаточной эффективности первого средства.
Используется назначение Гх и при достижении клинико-лабораторной ремиссии на фоне применения монотерапии другим БПВП. Обычно достигнув клинико-лабораторной ремиссии при применении любого БПВП, мы продолжаем лечение еще в течение не менее 6 мес, чтобы убедиться в отсутствии и рентгенологического прогрессирования. И в этот период к первому БПВП (метотрексата или лефлуномид и др.) мы присоединяем применение Гх в дозе 400 мг/сут. При отсутствии обострения или появления новых эрозий мы постепенно отменяем первый препарат в течение 1–3 мес и продолжаем лечение Гх в течение 6–12 мес (то есть снижаем агрессивность терапии базисными средствами, имеющими худший профиль переносимости по сравнению с Гх). При отсутствии появления признаков активности РА и прогрессирования деструкции базисная терапия Гх прекращается. В случаях даже минимального обострения базисная терапия прерываться не должна.
Следует отметить, что у больных с высоким риском кардиоваскулярных нарушений, с гиперхолестеринемией применение Гх как второго БПВП с учетом его гиполипидемического действия может привести к положительному эффекту и в отношении риска развития (или усугубления) атеросклероза.
Таким образом, на современном этапе препарат Гх показан на ранних этапах артрита (в период дифференциально-диагностических мероприятий), при комбинированной терапии БПВП для поддержания клинико-лабораторной ремиссии, а также у больных с гиперлипидемией.
При РА очень важен принцип длительного непрерывного лечения БПВП. Поэтому врач должен быть хорошо ориентирован в спектре возможных побочных реакций того или иного БПВП для организации правильного мониторинга за переносимостью лечения: кратности осмотров, проведения лабораторных анализов или инструментальных обследований и т.д. Необоснованная отмена БПВП и следующий за этим перерыв в базисной терапии приводят к обострению воспаления, которое не всегда удается подавить при возобновлении применения препарата через несколько месяцев, что ухудшает течение болезни.
Но даже при грамотном подходе к лечению больных РА классическими БПВП (раннее начало терапии и постоянный контроль за степенью подавления активности, прогрессирования болезни, переносимостью лечения) тяжелый вариант болезни все же развивается. По нашим данным и данным литературы у 15–25% больных последовательно назначаемые БПВП не приводят к развитию выраженного эффекта (хороший эффект по критериям EULAR либо у >50% улучшение по критериям ACR) или приводят к развитию побочных реакций, требующих отмены базисного средства. Создание ГИБП позволило в значительной степени оптимизировать лечение больных РА.
С учетом высокой стоимости ГИБП большое значение имеет отбор пациентов, нуждающихся в таком лечении. В первую очередь — это больные, у которых, несмотря на применение БПВП, сохраняется высокий темп прогрессирования либо риск быстрого прогрессирования, то есть высокий уровень СРБ, сохранение припухлости в суставах и т.п.
Как показано в исследовании BeST (Landewe R.B.M. et al., 1994), при неэффективности двух последовательно назначенных классических БПВП дальнейшее применение других БПВП не приводит к развитию эффекта. Поэтому во многих странах Европы одним из критериев отбора больных для назначения ГИБП является неэффективность двух БПВП.
Оценка риска рентгенологического прогрессирования и уровень активности — основные параметры, которые, по мнению экспертов, следует учитывать при назначении комбинированной терапии при РА.
Мониторинг комбинированной терапии должен быть тщательным, поскольку возможно повышение частоты побочных реакций.
Список использованной литературы
1. Имаметдинова Г.Р. (1998) «Оценка эффективности и переносимости метотрексата и его комбинаций с плаквенилом и циклоспорином А (сандиммун) у больных ревматоидным артритом». Автореф. дисс. … канд. мед. наук, 24 стр.2. Насонов Е.Л. (1996) Противовоспалительная терапия ревматических болезней Москва, 160–181.3. Насонов Е.Л. (ред.) (2010) Ревматология. Клинические рекомендации. 2-е изд., исправ. и доп. ГЭОТАР-Медиа, Москва, с. 111–112.4. Сергиец Н.А., Еров Н.К. (2009) Комбинированная базисная терапия ревматоидного артрита метотрексатом и плаквенилом, Научно–практич. ревматология, 1: 30–35.5. Чичасова Н.В., Насонов Е.Л. (2004) Стратегия базисной терапии ревматоидного артрита; Доктор Ру. 3: 6–10.6. Шехтер А.Б., Крель А.А., Чичасова Н.В. (1985) Клинико-морфологические сопоставления при различных вариантах ревматоидного артрита (по данным пункционных биопсий синовиальной оболочки). Терапевтический архив, 8: 90–100.7. Agrawal S., Misra R., Aggarwal A. (2007) Autoantibodies in rheumatoid arthritis: association with severity of disease in established RA. Clin. Rheumatol., 26: 201–204.8. Baker D.G., Baumgarten D.F., Dwyer J.P. (1984) Chloroquine inhibits of production of mononuclear cell factor by inhibits of lectin binding Arthr. Rheum., 1984, 27: 888–896.9. Combe B., Landewe R., Lukas H.D. et al. (2007) EULAR recommendation for the management of early arthritis: report of taask force of the European Standing Committee for International Clinical Studies Including Therapeutics (ESCISIT) Ann. Rheum. Dis., 66: 34–45.10. Emery P. (1995) Therapeutic approaches for early rheumatoid arthritis. How early? How aggressive? Brit. J. Rheum., 34(2): 87–90.11. Farr M., Bacon P.A. (1995) How and when should combination therapy be used? The role of an anchor drug. Brit. J. Rheum., 34(2): 100–103.12. Fox R.I. (1993) Mechanism of action of hydroxychloroquine as an antirheumatic drug. Sem. Arthr. Rheum., 23(9). 10: 82–91.13. Goecor– Ruiterman Y.P., de Vries–Bouwstra J.K., Allaart C.F. et al. (2005) Clinical and radiographic outcomes of four differenet treatment strategies in pations with early rheumatoid arthritis (the BeST study): a randomised, controlled trial. Arthr. Rheum., 52: 3381–3390.14. Kalden J.R., Schattenkirchen M. et al. (2003) Efficacy and safety of leflunomide in patients with active rheumatoid arthritis: a five–year follow–up’ Arthr.Rheum., 48: 1513–1520.15. Landewe R.B.M., Dijkmans B.A.C., van der Woude F.J. et al. (1994) Long–term cyclosporine in patients with rheumatoid arthritis» Arthr. Rheum., 37(l): S–361.16. Nielen M. M., van Schaadenburg D., Reesnik H. W. et al. (2004) Specific autoantibodies precede the symptoms of rheumatoid arthritis: a study of serial measurement in blood donors. Arthr. Rheum., 50: 380–386.17. Paulus H.E. (1993) Protocol Development for combination therapy with disease–modifying antirheumatic drugs. Sem. Arthr. Rheum., 23(1): 19–25.18. Picot S. (1991) Chloroquine inhibits tumor necrosis factor production by human macrophages in vitro. J. Infect. Dis.,164: 830–831.19. Pincus T., Marcum S.B., Callahan L.F. (1992) Long–term drug therapy for rheumatoid arthritis in seven rheumatology private practices. J. Rheum., 19 :1885–1894.20. Saag K.G., Teng G.G., Pather N.M. et al. (2008) American College of Rheumatology 2008 recommendations for the use of nonbiologic and biologic disease-modifying antirheumatic drugs in rheumatoid arthritis. Arthritis Care & Research, 59: 762–784.21. Sperber K., Quraishi H., Kalb T.H. et al. (1993) Selective regulation of cytokine secretion by hydroxychloroquine: inhibition of interleukine 1 alpha (IL–1 alpha) and interleukine 6 in human monocyte and T cell. J. Rheum., 20: 803–808.22. VcChesney E.W. (1983) Animal toxicity and pharmacokinetics of hydrocloroquine sulphate Am. J. Med., 75: 11–18.
Г.О. Проценко
Резюме. В огляді обґрунтовано застосування гідроксихлорохіну в лікуванні ревматоїдного артриту. Визначено схеми базисної терапії даним препаратом.
Ключові слова: ревматоїдний артрит, лікування, гідроксихлорохін.
G.A. Protsenko
Summary. The administration of hydroxychloroquine in management of patients with rheumatoid arthritis is reviewed in the article. The schemes of disease-modifying threatment with the preparation are defined.
Key words: rheumatoid arthritis, threatment, hydroxychloroquine.
Адрес для переписки:Проценко Галина Александровна03680, Киев, ул. Народного ополчения, 5ННЦ «Институт кардиологииим. акад. Н.Д. Стражеско» НАМН Украины
www.rheumatology.kiev.ua
ревматоидный артрит: принципы, медикаментозная терапия
Общие принципы лечения
При лечении ревматоидного артрита врач должен стремиться к подавлению воспалительного процесса в суставах и к ремиссии заболевания. В результате устраняется болевой синдром, замедляется деструкция суставов, сохраняется функциональная способность, улучшается качество и продолжительность жизни.

Для этого врач будет использовать целую совокупность лечебных мероприятий, включающих лекарственную терапию и немедикаментозные методы — диету, физиолечение, лечебную физкультуру, хирургические методы (консервативные и ортопедические). Серопозитивный и серонегативный ревматоидные артриты при всех различиях практически не имеют таковых в лечении.
В последнее время изменились взгляды на выбор препаратов и сроки лечения ревматоидного артрита. Связано это с тем, что появились доказательства обратимости патологического процесса на ранних стадиях заболевания. Поэтому врач совсем не обязан зацикливаться на старых схемах терапии и заниматься гомеопатией. Злоупотребление антибиотиками ведет к нагрузке на печень и снижению иммунитета, что может привести к оппортунистическим инфекциям. Тогда как вылечить ревматоидный артрит?
Фундамент лечения составляет лекарственная терапия. Она может быть направлена на купирование симптомов заболевания и на перестройку его течения. Препараты для лечения ревматоидного артрита подбирает только врач. Это базисные медленнодействующие противовоспалительные препараты, нестероидные противовоспалительные средства, глюкокортикоиды и новейшие препараты — биологические агенты.
Базисные противовоспалительные препараты
Эти лекарства относятся к группе препаратов, модифицирующих течение заболевания. Применять их начинают на ранних стадиях, причем если отмечаются как серопозитивный, так и серонегативный вариант ревматоидного артрита у пациента. Препараты базисной терапии принимаются длительно. Даже при наступлении стойкой ремиссии заболевания их не отменяют, врач всего лишь снижает дозу. К препаратам базисной терапии ревматоидного артрита относятся:
- метотрексат;
- сульфасалазин;
- лефлуномид.
Метотрексат
Метотрексат можно назвать препаратом выбора базисной противовоспалительной терапии. Привыкания организма к нему не возникает на протяжении пяти лет. Его применение в начале заболевания позволяет значительно замедлить эрозивный процесс.
Применение низких доз метотрексата даёт противовоспалительный и иммунодепрессивный эффект. Его удобно принимать, можно пить всего раз в неделю. Разовая еженедельная доза колеблется от 7,5 до 25 мг.
Метотрексат можно использовать и внутримышечно, чаще это по 50 мг один раз в месяц с обязательным контролем лабораторных и клинических показателей.
Этот препарат эффективен при любых вариантах ревматоидного артрита (серопозитивный, серонегативный), но его ограничивают у людей, страдающих почечной или печеночной недостаточностью, сахарным диабетом, гепатитами В или С, пожилых и особенно злоупотребляющих алкоголем. Врач перед назначением обязательно должен уточнить об имеющихся противопоказаниях.
Сульфасалазин
Лечение аутоиммунных заболеваний сульфасалазином, в том числе и ревматоидного артрита, применяется уже очень давно. Он эффективен на более ранних стадиях заболевания, если артрит серонегативный. А также в тех случаях, когда в организме имеются очаги хронических инфекций и противопоказаны другие препараты базисной терапии.
Побочные действия этого препарата в основном связаны с воздействием на работу кишечного тракта (отсутствие аппетита, тошнота, рвота, боли в верхних отделах живота, поносы). Также неудобство выражается в том, что принимать его необходимо ежедневно (чаще всего назначают по 2 таблетки утром и по 2 вечером). Чтобы уменьшить побочное действие, можно назначить сульфасалазин в постепенно возрастающей дозировке. Врач, как правило, назначает в таких случаях лечение с одной таблетки в сутки.

Лефлуномид
Этот препарат можно назвать сравнительно новым в лечении ревматоидного артрита. Доказано, что лефлуномид не только убирает воспаление, но и тормозит разрушение суставов. Его относят, наряду с метотрексатом, к препаратам первого ряда, особенно его считают эффективным, если заболевание носит серопозитивный характер.
Из побочных действий, как и у сульфасалазина, следует отметить боли в верхних отделах живота, тошноту и понос. Из негативных моментов можно также отметить и высокую рыночную стоимость этого препарата.
Назначают лефлуномид сначала по 100 мг первые трое суток. Затем врач назначает поддерживающую дозу исходя из личных особенностей пациента, чаще всего по 20 мг ежедневно.
Нестероидные противовоспалительные средства (НПВС)
Препараты этой группы подавляют действие фермента циклооксигеназы. Он играет существенную роль в защите слизистой желудка, агрегации тромбоцитов, функции почек, дифференциации макрофагов.
НПВС уменьшают болевые явления, но они не могут предотвратить деструктивных явлений в суставах. Тем самым они маскируют прогрессирование процесса, что очень опасно, а также вызывают ряд побочных осложнений (нарушение функции почек, желудочно-кишечные кровотечения и др.). Выбор того или иного НПВС делает конечно же лечащий врач исходя из индивидуальных особенностей пациента и наличия противопоказаний. В последнее время наиболее популярны:
- ибупрофен;
- диклофенак;
- индометацин;
- кетопрофен.
Глюкокортикостероиды
Препараты этой группы обладают самым быстрым противовоспалительным эффектом. К ним относят преднизолон и метилпреднизолон. Лечение этими препаратами начинают с малых доз — обычно не больше 10 мг в сутки (в пересчете на преднизолон). Применение более высоких доз делают только в исключительных случаях. К сожалению, если было начато системное применение глюкокортикостероидов, то их отмена в дальнейшем обязательно приводит к обострению. Поэтому делают это всегда постепенно.
Возможно внутрисуставное введение этих препаратов, что дает неплохие результаты в лечении. При этом предварительно из сустава удаляют внутрисуставную жидкость. Проведение такой процедуры строго регламентируется лечащим врачом.
Длительный прием глюкокортикосероидов может привести к ожирению, сахарному диабету, недостаточности коры надпочечников, повышению артериального давления и др. Также во время такой терапии необходимо следить за уровнем глюкозы в крови, уровнем калия и кальция.
Новые лекарственные препараты: биологические агенты
Эти препараты считают новым словом в лечении аутоиммунных заболеваний. Создают их с помощью генной инженерии. Механизмы их действия в организме очень сложны и нуждаются в отдельном описании. Главное, что действуют они крайне избирательно, блокируя отдельные цитокины или даже клетки. К ним относятся:
- актерма;
- мабтера;
- инфликсимаб;
- этанерсепт.
Похожие статьи
pozvonochnikok.ru
Традиционная базисная терапия ревматоидного артрита uMEDp
Целью противоревматической терапии, согласно совместной международной программе EULAR и ACR Target to target, является достижение ремиссии или низкой активности ревматоидного артрита (РА). Эта цель вполне достижима на ранней стадии РА, когда еще не сформировались необратимые изменения суставов и восприимчивость больного к базисным противовоспалительным препаратам (БПВП) наиболее высока.На сегодняшний день традиционная базисная терапия остается методом выбора для этой категории больных. Несмотря на большие успехи, которые были достигнуты в области разработки и практического внедрения генно-инженерных биологических препаратов (ГИБП), эксперты ACR и EULAR предлагают начинать лечение РА с традиционных БПВП.
В настоящее время в качестве первого БПВП обычно назначается метотрексат (МТ). Однако не исключено, что для широкой клинической практики лефлуномид (ЛФ) может оказаться даже более перспективным препаратом, чем МТ. Последний рекомендуется назначать в небольшой дозировке и в последующем повышать ее до необходимого уровня с учетом эффективности и переносимости.
На практике на такое титрование дозы уходит довольно продолжительное время, а зачастую оно вообще не проводится, и возможности препарата реализуются не полностью. ЛФ назначается по ста дартной схеме, что для широкой практики гораздо удобнее.
С начала XXI века методы лечения ревматоидного артрита существенно модифицировались. Эти изменения были подготовлены, с одной стороны, результатами масштабных клинических исследований, а с другой – крупными достижениями в области разработки и производства противоревматических препаратов. Одним из ключевых факторов, определивших развитие ревматологии в последние два десятилетия, явилась концепция необходимости раннего активного лечения РА. Ее авторы подчеркивали, что данное заболевание не может рассматриваться как относительно доброкачественное, поскольку оно приводит к очень неблагоприятным последствиям для больного [1]. Хроническое аутоиммунное воспаление сопровождается формированием необратимых изменений, которые обусловливают тяжелые функциональные нарушения и стойкую инвалидизацию пациентов.Кроме того, в исследованиях, проведенных с участием больших контингентов больных, показано: РА обусловливает не только дискомфорт и значительную функциональную недостаточность, но и существенное сокращение продолжительности жизни пациентов за счет возникновения кардиоваскулярных нарушений, связанных с атеросклерозом [2]. Столь агрессивный характер заболевания вполне может оправдать определенный риск, который связан с применением потенциально токсичных противоревматических препаратов. Идея раннего активного лечения была с пониманием встречена врачебным сообществом и за сравнительно короткий срок успела принести вполне ощутимые плоды.
В последние годы XX века было зафиксировано существенное снижение тяжести РА, что может быть связано в первую очередь с широким внедрением в клиническую практику метотрексата. Th eodore Pincus и соавт., которые сравнивали больных РА, находившихся под наблюдением ревматологов в 1985 и 2000 гг., отмечают резкое увеличение числа пациентов, получавших базисные противовоспалительные препараты, и прежде всего МТ [3]. Такое изменение характера терапии сопровождалось значительным уменьшением основных показателей активности болезни и существенным замедлением деструкции суставов.
В 1990-х гг. арсенал противоревматических препаратов значительно увеличился. В распоряжении ревматологов появился новый синтетический БПВП лефлуномид (Арава) и был создан еще один класс болезньмодифицирующих средств – генно-инженерные биологические препараты. Однако не будет большим преувеличением сказать, что МТ и глюкокортикоиды также были открыты именно в этот период. Хотя они были разработаны еще в 1940-х гг., лишь в конце XX века были проведены исследования, убедительно доказавшие, что эти лекарства обладают болезнь-модифицирующими свойствами. Такие работы стали возможны благодаря использованию в ревматологии принципов доказательной медицины.
Совершенствование методики клинических испытаний позволило резко сократить промежуток времени от экспериментальных исследований нового препарата до его внедрения в клиническую практику. При этом количественные методы оценки воспалительной активности, разработанные для научных исследований, хорошо себя зарекомендовали в клинических испытаниях как надежное средство контроля эффективности проводимой терапии. Позднее количественная оценка активности все шире стала использоваться для ведения больных в условиях рутинной клинической практики.
Внедрение в клиническую практику эффективных противоревматических препаратов и появление надежных методов определения воспалительной активности позволило сформулировать современные принципы лечения РА. Согласно этим принципам, целью противоревматической терапии является ремиссия или низкая активность заболевания. Эта цель представляется достижимой на ранней стадии РА, когда еще не сформировались необратимые изменения суставов и восприимчивость больного к БПВП наиболее высока. Не исключено, что лечение, которое назначается на самом раннем этапе, способно серьезно изменить отдаленный прогноз заболевания. В этой связи вопросы ранней диагностики и раннего лечения РА привлекают к себе особое внимание. Учитывая значимость этой проблемы, ревматологи Европы и США объединили свои усилия для создания новой системы диагностики РА. В результате этой работы были подготовлены современные диагностические критерии, которые позволяют установить диагноз уже в самом начале развития болезни [4]. Это дает возможность врачу обосновать назначение БПВП и своевременно начинать лечение при наличии признаков активного артрита.
На сегодняшний день традиционная базисная терапия остается методом выбора для этой категории больных. Несмотря на большие успехи, которые были достигнуты в области разработки и практического внедрения ГИБП, эксперты Американской коллегии ревматологов (ACR) и Европейской антиревматической лиги (EULAR) единодушно предлагают начинать лечение РА с традиционных БПВП [5, 6]. Однако они не смогли прийти к единому мнению по вопросу о выборе конкретного препарата. Известно, что любой БПВП дает оптимальный эффект у тех больных, которым такая терапия еще не проводилась. При этом даже небольшое промедление с назначением лечения может отрицательно повлиять на его результат [7]. Вот почему выбор первого БПВП может во многом определять эффект противоревматической терапии.
Специалисты EULAR предлагают в качестве первого БПВП использовать метотрексат, а если его применение по каким-либо причинам нежелательно, назначать либо лефлуномид (ЛФ), либо сульфасалазин, либо препараты золота [6]. Авторы данной рекомендации отмечают, что она основана исключительно на данных рандомизированных клинических испытаний, не все члены экспертной группы были согласны с таким решением, поскольку оно не согласуется с тем опытом, который был накоплен в практической медицине. На практике соли золота уже не используются в качестве препаратов первого ряда из-за их высокой токсичности, а сульфасалазин не относится к числу наиболее эффективных средств [8]. Решение EULAR прочно закрепляет лидирующее положение МТ и затрудняет изучение альтернативных вариантов традиционной базисной терапии при раннем РА.
В отличие от своих европейских коллег эксперты ACR не полагаются исключительно на результаты клинических испытаний. При разработке рекомендаций они учли тот опыт применения БПВП, который был накоплен в реальной практике. Ввиду этого они не включили золото в число препаратов, которые могут быть использованы при раннем РА, и рекомендовали назначать сульфасалазин лишь при отсутствии неблагоприятных прогностических факторов, таких как функциональная недостаточность, внесуставные проявления РА, ревматоидный фактор, антитела к циклическому цитруллинированному пептиду, эрозии костей на рентгенограммах.
В рекомендациях ACR метотрексат не выделяется как основной препарат для лечения раннего РА. Вместо этого предлагается использовать на выбор МТ или ЛФ при любой длительности и любой активности болезни независимо от наличия неблагоприятных прогностических факторов. Такая формулировка показывает, что, по мнению экспертов, ЛФ может реально конкурировать с МТ в рутинной клинической практике. Кроме того, эта рекомендация позволяет врачам накапливать свой собственный опыт использования ЛФ у наиболее перспективного контингента больных РА – недавно заболевших пациентов, которые ранее не получали БПВП. И не исключено, что для широкой клинической практики ЛФ может оказаться даже более перспективным препаратом, чем МТ.
Метотрексат рекомендуется назначать в небольшой дозировке и в последующем повышать ее до необходимого уровня с учетом эффективности и переносимости [9]. На практике на такое титрование дозы уходит довольно продолжительное время, а зачастую оно вообще не проводится, и возможности препарата реализуются не полностью. Лефлуномид назначается по стандартной схеме, что для широкой практики гораздо удобнее. Стандартная схема использования ЛФ предусматривает применение высоких доз (100 мг/сут) в первые три дня, после чего назначается постоянная поддерживающая доза (20 мг/сут) в течение всего периода лечения. Это позволяет в течение нескольких дней создавать терапевтическую концентрацию препарата в крови и получать эффект гораздо быстрее, чем при назначении МТ [10]. Несмотря на такое быстрое улучшение, снижение активности может продолжаться довольно длительное время.
В клинических испытаниях наиболее выраженная динамика была зафиксирована в течение первых 3 месяцев, и по этим результатам был сделан вывод, что эффект может быть получен через 1–3 месяца от начала лечения [11]. Однако по современным представлениям лечение должно обеспечивать не просто улучшение, а низкую активность болезни или ремиссию. Определение временного промежутка, необходимого для получения максимального эффекта ЛФ, который назначается по стандартной схеме, стало одной из задач, решавшихся при анализе материала, полученного при использовании препарата в российских медицинских учреждениях [12].
В ходе первого этапа работы в исследование было включено 200 больных РА, наблюдавшихся в 4 медицинских центрах г. Москвы. 196 из них получали ЛФ не менее 4 недель, 192 – 8, 188 – 12 и 175 – не менее 16 недель. В последующем обсервационном исследовании наблюдались 214 больных РА. 208 из них принимали препарат не менее 4, 202 – 8, 195 – 12, 188 – 16, 182 – 20 и 174 – не менее 24 недель. Таким образом, в общей сложности проведено лечение 414 больных, которые получали лефлуномид в среднем 18,4 ± 5,7 недель. Среди них было 380 женщин и 34 мужчины в возрасте от 16 до 75 лет (в среднем 50,5 ± 12,6 лет). Давность заболевания варьировала от 1 месяца до 45 лет (в среднем 7,4 ± 7,3 лет). 330 больных были серопозитивны по ревматоидному фактору. Все больные принимали нестероидные противовоспалительные препараты, 121 получал глюкокортикоиды в дозе от 2,5 до 20 мг/сут (в среднем 2,9 ± 4,7 мг/сут). Всего за время наблюдения у 52 из 414 больных лечение было прервано из-за побочных реакций и у 18 – из-за недостаточной эффективности.
Уже через месяц от начала терапии отмечалась достоверная положительная динамика клинических признаков и суммарных показателей активности РА, которая существенно увеличивалась на протяжении 6 месяцев лечения. Достоверное уменьшение индекса активности РА DAS28 по сравнению с предыдущим исследованием отмечалось после 4-й, 8-й, 12-й, 16-й и 24-й недели. Снижение DAS28 в период с 16-й по 20-ю неделю не было статистически достоверным. Аналогичная динамика была зафиксирована и для числа болезненных и припухших суставов. В то же время динамика других показателей активности артрита не была так четко связана с изменениями суммарного индекса. Так, достоверное улучшение, по общей оценке состояния здоровья больным, было зафиксировано после 4-й, 8-й, 12-й, 16-й и 20-й недели. СОЭ достоверно уменьшалась лишь после 4-й недели. Позднее улучшение этого показателя, достигнутое в первый месяц лечения, сохранялось, но дальнейшего существенного снижения не отмечалось. Утренняя скованность достоверно уменьшалась после 4-й и 8-й недели лечения. Существенное уменьшение выраженности артралгий происходило ежемесячно на протяжении всего периода наблюдения [12].
Похожие результаты получили и наши зарубежные коллеги, которые оценивали результаты применения стандартной схемы лечения ЛФ у 402 больных РА [13]. Средний возраст пациентов в этой группе составил около 55 лет, средняя длительность заболевания приближалась к 10 годам. До включения в исследование пациенты получали в среднем около 3 БПВП. Больные были рандомизированы на две группы. В обеих группах лечение начинали с насыщающих доз по 100 мг/сут в первые три дня, после чего 202 пациента получали ЛФ по 10 мг/сут и 200 – по 20 мг/сут. В обеих группах число больных с 20-процентным улучшением по критериям ACR достигало максимума после 3 месяцев лечения, но число пациентов с 50- и 70-процентным улучшением продолжало увеличиваться в течение всех 6 месяцев наблюдения. Таким образом, для того чтобы достоверно оценить эффективность ЛФ, который назначается по стандартной схеме, требуется не менее 4–6 месяцев.
Опыт использования ЛФ в условиях реальной клинической практики показывает, что у некоторых категорий больных назначение высоких доз препарата в первые три дня лечения может способствовать увеличению частоты нежелательных явлений. Chokkalingam Siva и соавт. анализировали результаты применения ЛФ у 3325 больных РА, которые наблюдались в медицинских учреждениях, обслуживающих ветеранов армии США [14]. В этой когорте преобладали мужчины (92%) пожилого возраста (47% были старше 65 лет). У 61% этих больных лечение проводилось по стандартной схеме с применением насыщающих доз по 100 мг/сут в течение трех дней. В 4% случаев насыщающая доза применялась в течение двух дней, в 3% использовались другие схемы насыщения, и в 31% насыщающие дозы не применялись.
На этом материале применение стандартной насыщающей дозировки по 100 мг/сут в течение трех дней приводило к увеличению вероятности отмены препарата. Karin Martin и соавт. назначали ЛФ 116 больным РА, наблюдавшимся в ревматологическом центре Бордо. Авторы отмечают: больные в их группе были гораздо тяжелее, чем те, что включались в рандомизированные клинические испытания ЛФ. До назначения ЛФ они получали гораздо большее количество БПВП, у них значительно чаще выявлялась коморбидная патология. Во всех случаях авторы жестко придерживались стандартной схемы лечения ЛФ, разработанной в ходе клинических испытаний. В результате в течение первого года лечения препарат был отменен в 70% случаев [15].Индивидуальный подбор терапии с учетом особенностей течения заболевания в каждом конкретном случае позволяет с успехом проводить лечение даже у тяжелых пациентов. L. Pisoni и соавт. представили данные по использованию ЛФ у 140 больных РА, наблюдавшихся в миланском ревматологическом центре [16]. Эта группа не имела существенных отличий от пациентов Karin Martin и соавт. В нее вошли пациенты, длительно страдавшие РА и получавшие ранее с неудовлетворительным результатом другие БПВП. Однако, в отличие от французских авторов, L. Pisoni и соавт. применяли более гибкий подход к назначению ЛФ и ведению пациентов с нежелательными явлениями. Насыщающая доза использовалась лишь у 25 из 140 больных (17,9%). Если ЛФ применялся для комбинированной базисной терапии, в течение первого месяца больные получали его по 10 мг/сут, а затем – по 20 мг/сут. Если возникали нетяжелые побочные реакции, доза снижалась, и многие пациенты чувствовали себя вполне удовлетворительно, получая ЛФ по 20 мг 3 или 4 раза в неделю. Данная группа наблюдалась в течение 30 месяцев, и за это время лечение было прекращено лишь у 26% ольных.
Принимая во внимание эти результаты, некоторые специалисты предлагают полностью отказаться от использования насыщающих доз. Однако их назначение далеко не всегда приводит к существенному ухудшению результатов лечения. Судя по данным, полученным при использовании ЛФ в российских учреждениях, переносимость стандартной схемы назначения ЛФ была вполне удовлетворительной [12]. Частота и спектр побочных реакций примерно соответствовали тем показателям, которые были зафиксированы при проведении клинических испытаний ЛФ [17, 18, 19]. По данным российских медицинских учреждений, в общей сложности за время лечения ЛФ нежелательные явления были зафиксированы у 152 из 414 больных (37%). Наиболее частыми побочными эффектами, связанными с приемом препарата, были изменения со стороны желудочно-кишечного тракта (тошнота, диарея, боли в животе, повышение активности трансаминаз) и кожные изменения (кожный зуд, сыпь, выпадение волос). Значительно реже отмечались респираторные инфекции, повышение артериального давления, головные боли. Другие нежелательные явления встречались в единичных случаях.
ЛФ был отменен из-за побочных реакций у 52 больных (12,6%). Наиболее частой причиной отмены были кожные изменения (у 19 больных). В 11 случаях препарат был отменен из-за диспепсических явлений (диарея, тошнота, боли в животе). У 6 больных лечение было прекращено из-за повышения активности трансаминаз. Другие побочные реакции приводили к необходимости отмены препарата лишь в единичных случаях. У 100 пациентов отмены препарата не потребовалось, и лечение было продолжено, но у 13 из них доза ЛФ была снижена до 10 мг/сут [12]. В работе Gyula Poor и соавт., применявших стандартные насыщающие дозы у всех пациентов, нежелательные явления были зафиксированы у 45% больных, получавших ЛФ в дозе 10 мг/сут, и у 50%, принимавших его по 20 мг/сут [13]. При использовании поддерживающей дозы 10 мг/сут лечение прекращено из-за побочных реакций в 15%, а при назначении ЛФ по 20 мг/сут – в 12% случаев.
D.H.N. White и соавт. (Окландский университет, Новая Зеландия) анализировали результаты использования ЛФ в условиях реальной клинической практики у 244 больных РА [20]. Средний возраст больных составил около 57 лет, средняя длительность болезни – около 12 лет. 73% больных получали стандартную насыщающую дозу 100 мг/сут в первые три дня и у 11% использовались другие насыщающие дозировки. При этом 64% больных продолжали лечение после 12 и 49,4% – после 24 месяцев наблюдения. Препарат был отменен из-за побочных реакций у 54 больных (22%). По мнению авторов, использование насыщающих доз не оказало существенного влияния на частоту нежелательных явлений. В этой работе стандартная схема лечения применялась в 73% случаев, и еще 17% получали модифицированные насыщающие дозы. По-видимому, врачи отказывались от назначения насыщающих доз наиболее угрожаемым пациентам, а остальные переносили их вполне удовлетворительно.
Применение насыщающих доз может представлять особый интерес при раннем РА, когда требуется как можно быстрее подавить активность заболевания. H. Kellner и соавт. обобщили результаты применения ЛФ в 174 центрах Германии [21]. В это открытое проспективное исследование было включено 308 больных с давностью РА не более года. Стандартная схема с насыщающими дозами препарата в течение первых трех дней применялась в 57,2% случаев. Больные наблюдались в среднем в течение 25,5 ± 6,0 недель. Достоверное улучшение по шкале DAS28 отмечалось у 84,6% больных и примерно с одинаковой частотой регистрировалось у лиц, получавших и не получавших ранее БПВП. Но хороший эффект чаще наблюдался у тех пациентов, которым ранее БПВП не назначались. Через 24 недели от начала терапии число больных с высокой активностью по DAS28 уменьшилось с 71% до 13,8%, и у 25% больных была получена клиническая ремиссия. Нежелательные явления наблюдались у 36 (10,8%) пациентов. Наиболее часто встречались диарея, тошнота, гипертензия и головные боли. За время наблюдения ЛФ был отменен у 11,1% больных, в том числе у 6,3% из-за побочных реакций.
Хорошая переносимость стандартной схемы с применением высоких доз в начале лечения отмечалась и в ходе анализа предварительных результатов назначения ЛФ больным с ранним РА, полученных в 20 медицинских центрах России [22]. К 6-му месяцу нежелательные явления зафиксированы у 1 больного (лейкопения). При этом 20-процентное улучшение по критериям ACR отмечалось у 31 из 51 (61%) больных. У 9 больных (18%) был получен 50-процентный эффект по ACR.
Времени опыт практического применения лефлуномида показывает, что его терапевтический потенциал может быть наиболее полно реализован при использовании дифференцированного подхода к выбору схемы лечения. Назначение насыщающих доз в начале курса может быть наиболее актуально на ранней стадии ревматоидного артрита, поскольку быстрое подавление активности у таких пациентов может благотворно повлиять на течение болезни в целом. Данные отечественных и зарубежных исследований демонстрируют: больные с ранним РА обычно вполне удовлетворительно переносят высокие дозы ЛФ и хорошо отвечают на лечение. В то же время при значительной давности заболевания вероятность побочных реакций может быть гораздо выше, особенно у лиц пожилого возраста при наличии серьезной сопутствующей патологии. В подобных случаях назначение ЛФ по 20 мг/сут без применения насыщающих доз дает возможность существенно уменьшить риск нежелательных явлений.
umedp.ru
Лечение ревматоидного артрита препаратами нового поколения
Вовремя начатое лечение ревматоидного артрита препаратами нового поколения дает шанс больным людям повысить качество и продолжительность жизни. Полностью вылечить его невозможно – это аутоиммунное заболевание, необратимо поражающее суставы. Активная терапия снимает болезненные симптомы и помогает сохранять работоспособность. При правильно подобранном лечении ремиссия может длиться всю жизнь.
Правильное лечение ревматоидного артрита
Цели лечения
Лечение проводится с целью избавить пациента от боли и воспаления, улучшить его общее состояние, затормозить разрушение тканей суставов, восстановить их функцию, предотвратить деформацию костей.
Задачи лечения зависят от стадии ревматоидного артрита:
- Если заболевание длится меньше года, а лучше меньше шести месяцев – возможно остановить эрозию в костях и суставах, добиться полной ремиссии и повысить качество жизни больных;
- Если артрит длится дольше двух лет, базовая терапия при ревматоидном артрите предотвращает осложнения;
- Если артрит находится на поздней стадии, требуются протезирование суставов и меры реабилитации.
Схема лечения
Главный принцип лечения – купировать симптомы и добиться устойчивой ремиссии.
Терапию начинают с симптоматических средств – назначают нестероидные противовоспалительные препараты (НПВП) и анальгетики; внутрь суставов вводят глюкокортикостероиды.
Главный элемент схемы лечения – базисные болезнь-модифицирующие антиревматические препараты (БМАРП). Они тормозят развитие болезни, облегчают симптомы, улучшают общее состояние. БМАРП являются незаменимым лечением суставов при ревматоидном артрите.
Назначить БМАРП необходимо не позднее трех месяцев с манифестации болезни. По возможности в терапию включают генно-инженерные биологические препараты (ГИБП).
Если есть инфекция, назначают соответствующие антибиотики.
Этапы лечения ревматоидного артрита на ранней стадии:
- Подбор подходящей дозировки НПВС — не дольше двух недель от начала заболевания;
- Лечение НПВП — не дольше шести недель от начала заболевания;
- Назначение БМАРП — не дольше, чем через три месяца от начала заболевания. Курс лечения БМАРП должен длиться не меньше полугода (чаще намного дольше).
- Оценивать эффективность лечения можно не раньше, чем через 3 месяца после назначения БМАРП.
Схема лечения ревматоидного артрита
Большая часть разрушительных необратимых изменений в суставах и костной ткани происходит в первые два года заболевания. Вовремя начатое лечение повышает вероятность спасти суставы и кости. Для достижения стойкой ремиссии существует ограниченное время.
Важно!
Врач может контролировать процесс развития ревматоидного артрита и снизить его скорость лишь в начальные два года заболевания. Лечение в первые два года заболевания позволяет достичь 80% ремиссии. При установившемся течении болезни подобрать действенную терапию трудная, иногда невыполнимая задача.
Лечение включает в себя обязательную диету с повышенным содержанием кальция и витамина Д, лечебную физкультуру, специальные упражнения.
Физиотерапия, курорты, хондропротекторы незначительно влияют на течение болезни.
При необратимых изменениях в суставах показано хирургическое вмешательство, так как медикаментозное лечение уже неэффективно.
Препараты
Бессмысленно самостоятельно искать и составлять список лучших лекарств от ревматоидного артрита при любой степени поражения суставов. Тщательным подбором препаратов и их дозировки должен заниматься только врач-ревматолог. Даже для него это может быть сложным делом.
Базисная терапия
Сразу после установления диагноза должна назначаться базисная терапия ревматоидного артрита: болезнь-модифицирующие антиревматические препараты (БМАРП), синоним: базисные противовоспалительные препараты (БПВП).
Если врач не назначает БМАРП, с точки зрения современных методов лечения ревматоидного артрита это грубая ошибка, которая приводит к потере драгоценного времени. Направленность терапии – максимальное снижение активности заболевания.
Базисные препараты для лечения ревматоидного артрита принимаются длительно в маленьких дозах. Через несколько недель или месяцев после начала приема суставные проявления исчезают.
Минусы БМАРП – все препараты высокотоксичны и требуют регулярного мониторинга показателей мочи и крови.
При инфекционных заболеваниях БМАРП должны быть временно отменены.
Базисная терапия ревматоидного артрита
Подавляющие иммунитет (иммуносупрессоры)
Реактивный артрит имеет аутоиммунную природу, применяются иммунодепрессанты – препараты, угнетающие иммунитет, синоним: цитостатики.
Золотой стандарт терапии – метотрексат. Он назначается первым при лечении ранних реактивных артритов.
Врач назначает дозу 10мг в неделю, каждый месяц оценивает ее эффективность и постепенно увеличивает. Максимальная доза метотрексата – 20 мг, одна таблетка в неделю.
Метотрексат показывает быстрые результаты: снимает воспаление, отеки в суставах ног и рук, уменьшает боль.
Побочные эффекты у метотрексата тяжелые, так как он подавляет иммунитет: страдают все системы организма.
Чтобы снизить его побочные эффекты, рекомендуется:
- Через сутки после приема применять фолиевую кислоту с целью предотвращения побочных эффектов, так как метотрексат является ее антагонистом. Доза фолиевой кислоты не должна быть выше дозы метотрексата;
- Одновременно с курсом метотрексата нельзя пить аспирин и нежелательно диклофенак;
- Заменять НПВП в день приема метотрексата на глюкокортикостероиды или снизить их дозировку;
- Исключить алкоголь и кофеин.
Метотрексат нельзя применять при аллергии, онкологических заболеваниях крови, анемии, нарушениях функций печени и почек, беременности и лактации.
Противопоказания к употреблению метотрексата
При непереносимости метотрексата его заменяют на аналоги: азатиоприн, инфликсимаб, левамизол, лефлуномид, меркаптопурин, тимодепрессин, циклоспорин.
На заметку!
Если терапия одним средством неэффективна, можно назначить комбинированную схему лечения двумя-тремя препаратами.
Препараты золота
Аналог иммуносупрессоров – препараты золота при ревматоидном артрите. Ауранофин, ауротиоглюкоза, натрия ауротиомалат обладают специфической активностью, подавляющей иммунитет.
Используются редко из-за частых побочных эффектов и отложенного во времени результата.
Д-пеницилламин
Пеницилламин – еще один препарат, угнетающий иммунитет. Входит в перечень жизненно-важных лекарственных средств. Может применяться для лечения ревматоидного артрита у детей. Имеет длинный список побочных эффектов, типичных для иммуносупрессоров.
Производные 5-аминосалициловой кислоты
Месалазин и сульфасалазин могут применяться в составе комплексной терапии вместе с метотрексатом.
Антималярийные (производные 4-аминохинолина)
Хлорохин (делагил) и гидроксихлорохин (плаквенил) – препараты, которыми лечат малярию. Показали эффект при терапии ревматоидного артрита.
Ингибиторы матриксных металлопротеиназ
Доксициклин и миноциклин врач назначает при необходимости.
НПВП и анальгетики
Нестероидные противовоспалительные препараты (НПВП) всегда применяются в начале терапии ревматоидного артрита. Они должны назначаться вместе с базисными препаратами. Эффект от приема НПВП можно оценить через 1-2 недели. НПВП быстро снимают воспаление и облегчают состояние больного: уменьшают болевой синдром и отеки, улучшают подвижность суставов. Скованность после утреннего подъема купируется.
По эффективности НПВП не отличатся, но обладают разной переносимостью. Поэтому при подборе врач ориентируется на индивидуальные реакции пациента. При появлении побочных реакций препарат заменяют на аналог.
В начале терапии обычно назначают в минимальной дозировке диклофенак, ибупрофен, индометацин, кетопрофен, нимесулид, флюрбипрофен, этодолак, целекоксиб.
Внимание!
Больной должен применять одновременно только один препарат НПВП.
Когда терапевтический эффект получен, дозу препарата снижают.
При приеме НПВП для контроля показателей раз в месяц больной должен сдавать общий анализ крови и мочи, раз в три месяца – кровь на АЛТ и АСТ, анализ кала на скрытую кровь.
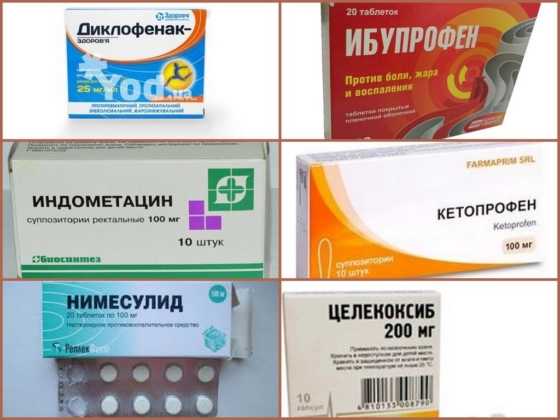
НПВП и анальгетики при артрите
НПВП токсичны, их нельзя применять при кровотечениях в ЖКТ, сниженном количестве тромбоцитов, сердечной, почечной и печеночной недостаточности, беременности и лактации.
Глюкокортикостероиды
Противовоспалительным действием обладают гормональные препараты. Они хорошо снимают воспаление и боль, их можно назначать в таблетках, инъекциях и наружных средствах. Преднизолон – популярный синтетический препарат из этой группы.
Дипроспан и дексаметазон – аналоги преднизолона.
При начальной стадии реактивного артрита низкие дозы глюкокортикостероидов тормозят развитие болезни и снижают ее активность. Они эффективны до применения базовой терапии. При внутрисуставном введении глюкокортикостероиды быстро снимают боль и воспаление, состояние сустава заметно улучшается.
Гормональные препараты вызывают привыкание и сбои в работе эндокринной системы, назначают их с осторожностью.
Генно-инженерные биологические препараты (ГИБП)
Генно-инженерные биологические препараты – лекарства последнего поколения:
инфликсимаб, адалимумаб, ритуксимаб, тоцилизумаб, этанерцепт, абатоцепт. Они избирательно действуют на процессы развития воспаления и останавливают их.
Биологические препараты усиливают эффект базисной терапии и показывают прекрасный результат.
Изобретение ГИБП совершило настоящий прорыв в терапии ревматоидного артрита.
Минусы: подавление противоопухолевой активности иммунитета, риск развития аллергических реакций, лечение этими препаратами очень дорого.
Важно!
Лечить ГИБП может только ревматолог с опытом работы с этими препаратами.
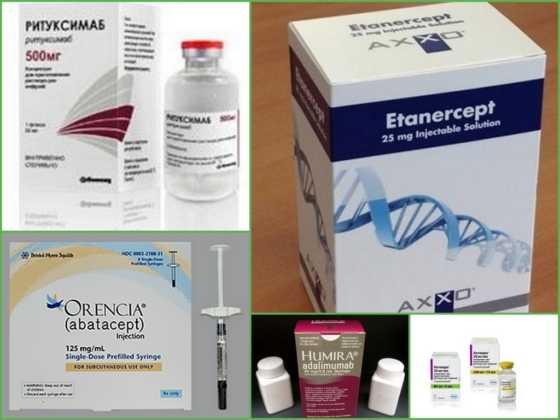
ГИБП при ревматоидном артрите
Если базисные препараты не дают результат
Если показатели больного улучшились менее чем на 20% после двух курсов базисной терапии, ему назначают комбинированные БМАРП, курс глюкокортикостероидов или генно-инженерные препараты нового поколения.
Вероятность инвалидности и летального исхода при отсутствии лечения ревматоидного артрита велика. При отсутствии ответа на лечение необходимо продолжать многолетние попытки поиска эффективных схем.
Что должен знать больной ревматоидным артритом
Пациент должен знать о специфике заболевания, характере его протекания, прогнозе, побочных эффектах, необходимости постоянной сдачи анализов.
Пациент должен знать стоимость всех препаратов и длительность лечения.
Врач должен сообщить об ограничениях в диете и образе жизни (обязательно – о необходимости отмены алкоголя и кофеина), недопустимости беременности и кормления грудью во время терапии.
Решение пациента о лечении должно быть осознанным. Ему стоит внимательно почитать отзывы больных о лечении ревматоидного артрита.
Ремиссию устанавливает врач, основываясь на состоянии больного и результатах анализов.
Прогноз
Варианты течения заболевания отличаются. У некоторых пациентов наблюдаются слабовыраженные симптомы, которые поддаются лечению и проходят через несколько месяцев.
В большинстве случаев ревматоидный артрит прогрессирует всю жизнь – лечение только тормозит процесс воспаления.
Если вовремя не начать лечить ревматоидный артрит, в 80% случаев через 5-6 лет наступает инвалидность. Важно лечить заболевание комплексно, с постоянным отслеживанием динамики. В этом случае велики шансы на сохранение работоспособности и активной жизни.
nogivnorme.ru
новые современные лекарства в России, препараты базисной терапии, нетрадиционные народные лекарственные средства
Ревматоидный артрит вызывает поражение преимущественно мелких суставов верхних и нижних конечностей. Патология характеризуется симметричным полиартритом, деформацией синовиальных соединений, образованием подкожных узелков, чувством скованности и ограничением подвижности. Для лечения ревматоидного артрита применяют препараты базисной терапии, противовоспалительные средства и глюкокортикостероиды.

Оглавление статьи
Общие сведения о болезни
Заболевание имеет аутоиммунную природу, в группе риска находятся люди с наследственной предрасположенностью и слабостью соединительных тканей. В некоторых случаях недуг развивается после перенесенного вирусного или инфекционного заболевания.
Женщины в 3 раза чаще болеют ревматоидным артритом, чем мужчины, средний возраст пациентов 40–50 лет. Патология сопровождается отеком, болезненностью суставов, местным повышением температуры тканей.
Внимание! Если не проводить лечение, суставная капсула начинает уплотняться, разрушаются хрящевые, костные ткани, сочленение деформируется.
Симптомы болезни прогрессируют медленно, проявляются утренней скованностью, которая проходит через 30–60 минут после пробуждения. Боли бывают острые и ноющие, усиливаются во время физических нагрузок. У 80% пациентов отмечаются признаки полиартрита, например, одновременно воспаляются голеностопные суставы на обеих ногах.

Кроме миалгии, больные отмечают нарушение работы сердечно-сосудистой, дыхательной, нервной системы. Возникают патологии почек, ухудшается зрение, образуются подкожные узелки, изменяется реологический состав крови.
Базисная терапия ревматоидного артрита
К препаратам первого ряда при лечении ревматоидного артрита относятся средства, воздействующие непосредственно на первичную причину болезни. Эффект от их приема заметен не сразу, лекарства не снимают симптомы недомогания, а результат пациенты ощущают не ранее, чем через месяц после начала базисной терапии.
Ревматологи применяют препараты нескольких групп: соли золота, иммунодепрессанты, антималярийные средства, сульфаниламиды, Д-пеницилламин. Лечение проводят комплексно, могут назначаться сразу 2 и более препаратов в сочетании с НПВП, низкими дозировками глюкокортикостероидов. Показанием к проведению терапии служит ревматоидный артрит средней и тяжелой степени, реактивное течение патологии.

Иммунодепрессанты (цитостатики)
Так как заболевание имеет аутоиммунную природу, во время лечения применяют цитостатики, подавляющие активность защитной системы организма. Лекарственные средства тормозят выработку аутоантител и иммунных комплексов, оказывают противовоспалительное действие, стимулируют выход протеолитических ферментов.
Если болезнь сопровождается развитием васкулита, протекает в псевдосептическом варианте, а другие базисные лекарства противопоказаны, глюкокортикоиды действуют слабо, а цитостатики наиболее эффективны.
Чаще всего применяют следующие иммунодепрессанты:
- Метотрексат,
- Циклофосфамид,
- Проспидин,
- Имуран.
Помните! Лечение цитостатиками может приводить к развитию побочных эффектов, поэтому прием лекарств должен проводиться строго по назначению врача.
Некоторые из данных средств вызывают развитие алопеции (облысение), нарушение функции детородных органов, увеличение печени, появление кожной сыпи, зуда.

Ребята! Мы запустили авторское сообщество на тему здоровья, фитнеса и долголетия.
Давай вместе построим экосистему, которая заставит нас развиваться, несмотря ни на что!
Вступай, если тебе не безразлично твое здоровье!

Соли золота
Препараты данной группы назначают на начальных стадиях ревматоидного артрита. Хороший терапевтический эффект отмечается у пациентов со стремительным течением болезни, если в крови сильно повышен титр аутоантител (серопозитивный РА), рано появились костные деструкции. А также средство базисной терапии показано для лечения ювенильного артрита у подростков.
Применение препаратов золота позволяет замедлить прогрессирование болезни, предотвратить разрушение хрящевых тканей, образование остеофитов, узур. Действующие вещества накапливаются в синовиальной оболочке, где тормозят аутоиммунную активность В-лимфоцитов.
Длительный прием солей золота помогает добиться стойкой ремиссии на 4–5 лет, у некоторых пациентов происходит регенерация костных эрозий, они могут полностью отказаться от обезболивающих. Улучшение состояния наблюдается через 2–3 месяца после начала приема препаратов.
Примеры препаратов золота:
- Кризанол,
- Санокризин,
- Ауропан,
- Ауранофин,
- Миокризин.
Важно! Во время ауротерапии регулярно делают анализ крови, мочи, проверяют состояние печени, почек. При выявлении нарушений курс прекращают.
Плохая переносимость препаратов золота наблюдается при серонегативном ревматоидном артрите. У пациентов появляется кожная сыпь, развивается диарея, нефротический синдром, стоматит, конъюнктивит, выпадают волосы.
Сульфаниламиды
Основным преимуществом медикаментов сульфаниламидного ряда считается их хорошая переносимость, они очень редко дают осложнения (10%) даже при длительном применении. Однако действие препаратов проявляется медленнее, чем при использовании других базисных средств. Улучшение состояния отмечается лишь спустя 3–4 месяца, а наилучшие результаты получают при приеме лекарств на протяжении 6–12 месяцев.
В состав Сульфасалазина и Салазопиридазина входит сера, угнетающая образование антител. Препараты оказывают умеренное противовоспалительное и иммунодепрессантное действие, назначаются при неэффективности солей золота, цитостатиков или Д-пеницилламина.
Другие базисные препараты (Д-пеницилламин, антималярийные средства)
Д-пеницилламин (Металкаптаза, Купренил) замедляет процесс склерозирования хрящевых тканей, снижает уровень ревматоидного фактора, подавляет аутоиммунные реакции в организме. Препараты прописываются при непереносимости солей золота, образовании подкожных узелков, поражении легких, серопозитивной форме заболевания.
Д-пеницилламин позволяет в 80% случаев добиться стойкой ремиссии даже при употреблении невысоких доз. У небольшого процента пациентов наблюдается «вторичная неэффективность», когда в начале лечения диагностируются улучшения, а позже развивается обострение.
Пеницилламин является токсичным, поэтому часто вызывает побочные проявления в виде диспепсических расстройств, тяжелого поражения почек и печени, легочного фиброза, миастении, кожной сыпи. Патологические симптомы возникают практически у 40% пациентов. При хорошей переносимости лечение проводят от 3 до 5 лет.
Антималярийные препараты – Гидроксихлорохин и Хлорохин являются наименее токсичными средствами базовой терапии, но их действие гораздо слабее перечисленных выше медикаментов. Оценить эффективность лечения можно спустя 6 месяцев.
Местные и системные лекарства от боли и воспаления
Для снятия болевого синдрома, уменьшения припухлости суставов, восстановления подвижности конечностей больным назначают нестероидные, селективные (Мовалис) противовоспалительные препараты. При прогрессирующем артрите показан прием глюкокортикоидов, гормональные средства быстро уменьшают воспалительный процесс, проходит озноб, гипертермия, утренняя скованность.
НПВС
Нестероидные противовоспалительные препараты назначают для уменьшения болей в суставах при ревматоидном артрите.
Внимание! Лекарства из группы НПВС снимают боль и отечность суставов, но не лечат заболевание, не воздействуют на аутоиммунные процессы, а потому не могут быть основой лечения.
Чаще всего больным назначают:
- Диклофенак,
- Кеторолак,
- Мовалис,
- Целекоксиб,
- Индометацин.
НПВП принимают внутрь в таблетированной форме или применяют мази на их основе. Лучший результат отмечается при комплексном использовании системных и наружных средств. Лекарства имеют большое количество побочных эффектов, не рекомендованы для длительного употребления, противопоказаны при болезнях ЖКТ.
Кортикостероиды
Гормональные препараты применяются для быстрой помощи больному с симптомами реактивного артрита. Для проведения терапии назначают Преднизолон, Дексаметазон, Медрол. После начала лечения признаки воспаления проходят в течение нескольких дней, больной не ощущает скованности в суставах по утрам, болевой синдром ослабевает или полностью проходит, нормализуется температура тела.
Но длительное применение глюкокортикоидов может оказать негативное влияние на большое количество внутренних органов, нарушить гормональный баланс. После прекращения приема нередко возникает синдром «отмены», когда симптомы болезни возвращаются в еще более тяжелой степени.
Внимание! Глюкокортикоиды назначают только при сильном повышении С-реактивного белка, неэффективности НПВП, развитии системных осложнений (синдрома Фелти, Стилла, полимиалгии).
При лечении ревматоидного артрита широко применяется методика внутрисуставного введения кортикостероидов. При таком способе терапии гормоны проникают непосредственно в очаг воспаления и меньше вреда причиняют организму.
Действия одной инъекции хватает на 3–4 недели, всего можно делать не более 5–8 уколов с перерывом 10 дней. Более длительное лечение нарушает структуру суставных тканей, вызывает ослабление связок, разрушение хряща.
Физиотерапия
После снятия острого воспаления назначают физиотерапевтические процедуры:
- электрофорез;
- УФО-облучение;
- ДМВ-терапия;
- лазерное, неоновое воздействие;
- магнитотерапия;
- лечебная гимнастика.
Курс лечения состоит из 10–15 сеансов.
Лечение ревматоидного артрита нетрадиционными методами
В дополнение к основным средствам базисной и симптоматической терапии можно использовать народные рецепты. Снять болевой синдром и уменьшить отечность помогают отвары из целебных трав, спиртовые настойки и мази для наружного применения, разные аппликации и компрессы – с камфорным спиртом, с глиной, капустным листом, медом, прополисом.

Фитотерапия
Для лечения ревматоидного артрита используют корень солодки, шалфей, плоды можжевельника, цветки полыни, кору белой ивы, листья березы, птичий горец. Растения или сборы заваривают в чашке (1 чайную ложку на 250 мл воды), накрывают крышкой на 5 минут, добавляют немного меда и пьют как обычный чай 3 раза в день. Можно готовить отвар (2 ст. л. на 0,4 л), настаивать 5–6 часов и принимать по 100 мл трижды в сутки. Длительность лечения составляет не менее месяца.
Для наружного применения травы настаивают с водкой 40% (1 ст. л. на 0,3 мл) в течение 21 дня. Затем лекарство процеживают и используют для растирки больных суставов. Противопоказанием служит стадия обострения с температурой и сильным воспалением.
Голодание
Соблюдение лечебного голодания стимулирует работу организма, в крови разрушаются белково-гормональные комплексы и альбумин в большей степени усваивается тканями. Терапия восстанавливает иммунную систему, способствует укреплению сосудов, выведению токсинов, уменьшению воспалительного процесса.
Голодание должно продолжаться не менее 5 дней, разрешается только пить чистую воду. Перед началом терапии следует проконсультироваться с врачом. Если больному трудно полностью отказаться от пищи, сначала рекомендуется соблюдать диету, исключающую животные жиры, сладости, кофе и алкоголь.
Домашние процедуры
Уменьшить симптоматику ревматоидного артрита помогают компрессы из черной редьки. Корнеплод очищают, измельчают на терке, добавляют столовую ложку облепихового масла и чайную ложечку бодяги. Состав перемешивают и прикладывают к проблемной области, сверху накрывают пленкой и хлопчатобумажной тканью. Компресс делают каждый вечер, оставляют на ночь.
Полезный совет! Снять боль и воспаление можно, регулярно принимая прохладные ванночки с отваром хвои, сабельника, зверобоя, плодов конского каштана, расплавленным парафином.
Могут ли народные методы вылечить РА
Ревматоидный артрит является хроническим прогрессирующим заболеванием, потому консервативное лечение и применение рецептов нетрадиционной медицины не сможет полностью вылечить патологию. Но при выполнении рекомендаций врача, регулярном профилактическом лечении можно добиться стойкой ремиссии и замедлить дистрофическое разрушение суставов.

Современные методы лечения ревматоидного артрита
Способы лечения РА постоянно расширяются, в дополнение к основным методам применяют новые препараты биологического действия. Модифицирующие средства подавляют гиперактивность иммунной системы, облегчают ревматические симптомы и не оказывают выраженного токсического действия.
Что такое моноклональные антитела
Одной из инновационных разработок генной инженерии является синтез моноклональных антител, вырабатываемых иммунными клетками. Препараты на их основе (Ритуксимаб) дают хороший результат при лечении ревматоидного артрита. Действующие вещества нейтрализуют В-лимфоциты, прерывая аутоиммунные реакции.
Лекарства не вызывают ослабления иммунитета, благодаря чему удается избежать появления побочных эффектов. Ритуксимаб вводят с помощью внутривенных инфузий, дозировка подбирается индивидуально. Генноинженерные препараты могут вызывать поражение печени, почек, сердца, аллергию. К недостаткам стоит отнести и очень высокую стоимость.
Новые препараты в России и за рубежом
Среди новинок фармацевтической индустрии выделяется препарат Олюминат, который является селективным ингибитором янус-киназы JAK1-2. Лекарство показано при неэффективности других базисных средств, назначается в комплексе с Метотрексатом или в качестве монотерапии.
Американские ученые запатентовали новый препарат для лечения ревматоидного артрита – Кевзара, являющийся копией человеческого моноклонального антитела. Kevzara быстро подавляет воспаление, снимает болевые ощущения.
Полезное видео
Предлагаем к просмотру видеоролик о новых подходах в лечении аутоиммунных болезней.
Заключение
Ревматоидный артрит вызывает поражение мелких синовиальных соединений, чаще всего страдают верхние и нижние конечности. Пациенты ощущают скованность, дискомфорт, жалуются на ограничение подвижности и деформацию суставов. Лечение недуга проводится препаратами базисной терапии, обезболивающими средствами и глюкокортикоидами. Дополнительно разрешается использовать народные рецепты на основе трав.
femalegs.ru