Глава 7. ВЫДЕЛЕНИЕ ГАММА-ГЛОБУЛИНА. 7 глобулин
Глава 7. ВЫДЕЛЕНИЕ ГАММА-ГЛОБУЛИНА
Широкое практическое применение в настоящее время имеет метод очистки, сводящийся к выделению гамма-глобулиновой фракции иммунных сывороток. Наиболее детально этот метод изучен применительно к получению так называемого «коревого» гамма-глобулина из человеческой крови:В последние годы интенсивно изучаются методы выделения гамма-глобулина из гипериммунных сывороток против клещевого энцефалита, бешенства, лептоспироза, сибирской язвы. Обнадеживающие результаты получены при выделении гамма-глобулина из некоторых антитоксических сывороток.
Принцип метода сводится к фракционированию сывороток спиртоводными осадителями при разных значениях рН и при температуре ниже нуля. Целью фракционирования является отделение иммунного гамма-глобулина от альбумина, альфа- и бета-глобулинов.
Очистка проходит в три стадии.1 стадия. Условия: концентрация спирта 25 %, Т °С 5 °С, рН 6,8-7,2 В осадок выпадает гамма-глобулиновая фракция; кроме того, он содержит значительные примеси, главным образом, бета-глобулина. Раствор, содержащий альбумины, а также часть альфа- и бета-глобулинов после отделения осадка путем фильтрации или центрифугирования выбрасывают. Осадок растворяют в солевом растворе (0,01 М - NаС1), после чего осуществляется вторая стадия очистки.2 стадия. Условия: концентрация спирта 13-17 %, Т °С -3...-6 °С, рН 5,1.В осадок выпадает бета-глобулин, липоидные вещества и небольшое количество альфа- и гамма-глобулинов. После отделения осадка раствор, содержащий очищенный гамма-глобулин, подвергается дальнейшей обработке.3 стадия. Условия: концентрация спирта 25-26 %, Т °С 5...6,5 °С, рН 7,0-7,2, NаС1 0,05-0,07 мл.В осадок выпадает гамма-глобулин.
Для лучшей очистки гамма-глобулина допускается переосаждение белковых осадков, полученных на 1-й и 3-й стадиях очистки. Повторным извлечением гамма-глобулина из балластных белков после 2-го осаждения достигается повышение выхода. Конечный выход гамма-глобулина составляет 8-10 % от общего белка сыворотки. Для удаления спирта и получения в сухом виде осадок подвергается сублимационному высушиванию.Сухой гамма-глобулин до растворения может сохраняться в вакуум-эксикаторе над хлористым кальцием или иным поглотителем влаги не долее одного месяца.Дальнейшей обработке может подвергаться и сырой осадок, максимально освобожденный от спирта путем суперцентрифугирования и отстаивания в течение 12-18 часов при температуре -5 °С. При изготовлении жидкого гамма-глобулина осадок растворяется в физиологическом растворе или дистиллированной воде (если растворяется сухой осадок, в котором содержится NаС1) так, чтобы довести количество белка до 10-10,5 %. Содержание NаС1 в растворе должно быть доведено до 0,85 %. В качестве консерванта к препарату добавляется мертиолят в конечной концентрации 1:15000.В 10 %-м растворе гамма-глобулина устанавливается рН 7,0-7,5 и с помощью рефрактометра точно проверяется количество белка. После этого раствор подвергается стерилизующей фильтрации при температуре 2-8 °С.
Разливка в ампулы производится после проверки-стерильности. Готовый препарат должен быть прозрачным или слегка опалесцирующим и содержать 10 % белка. Каждая серия контролируется методом электрофореза. Выпуск препарата допускается в том случае, если гамма-глобулиновая фракция составляет 97 % от количества общего белка.
Содержание спирта в готовом препарате в тех случаях, если обработке подвергался сырой осадок, не должно превышать 4,5 %. Каждая серия профильтрованного гамма-глобулина подвергается контролю на стерильность и безвредность. Отличие от контроля безвредности сывороток заключается в количестве вводимого препарата (свинке вводится 1 доза гамма-глобулина) и длительности срока наблюдения (за мышами наблюдают 4 дня). Годным признается препарат, не вызывающий общих и местных реакций в течение периода наблюдения.
Препараты гамма-глобулина должны сохраняться при температуре 4-10 °С. Срок годности их полтора года; по истечении этого срока, если препарат не изменил своих физических свойств, он может применяться в течение еще одного месяца.
Применение сывороточных препаратовСыворотки и гамма-глобулины применяются с профилактическими и лечебными целями. И в том и в другом случаях важно, чтобы антитела быстро проникали в кровь. В связи с этим препараты эти вводят внутримышечно, откуда они быстро всасываются. Применяемое раньше внутривенное введение теперь не практикуется из-за возможных при этом способе введения шоковых реакций. Известно, что сывороточные препараты, содержащие чужеродный для человеческого организма белок, вызывают сенсибилизацию его; при повторных введениях препарата, аналогичного происхождения это приводит к развитию нежелательных реакций повышенной чувствительности.
Очищенные от балластных белков сыворотки в значительной степени, но не совсем, освобождаются от сенсибилизирующих свойств. В связи с этим как нативные, так и очищенные сывороточные препараты должны вводиться с соблюдением определенных правил предосторожности. В настоящее время все иммунные сыворотки снабжаются разведенной (1:100) очищенной лошадиной сывороткой, разлитой в отдельные ампулы по 1 мл. Эта сыворотка предназначена только для выявления состояния повышенной чувствительности у детей и взрослых к белку лошадиной сыворотки. Для лечения и профилактики инфекционных болезней она не применяется.
Разведенную сыворотку употребляют непосредственно перед введением лечебной или профилактической дозы всех видов антитоксических сывороток с целью предупреждения анафилактических реакций. Сыворотка вводится внутрикожно в сгибательную поверхность предплечья в объеме 0,1 мл. Наблюдение за реакцией ведется в течение 20 минут.Если диаметр папулы за это время не превышает 0,9 см и вокруг нее отмечается ограниченная гиперемия, реакция считается отрицательной. В таком случае иммунную сыворотку вводят подкожно, сначала в количестве 0,1 мл, если реакция отсутствует - через 30 мин - 1 час всю остальную.При положительной реакции на разведенную сыворотку, введенную внутрикожно, папула увеличивается в диаметре до 1-3 и более сантиметров и окружена большой зоной гиперемии. В этом случае, если имеются безусловные показания к введению сыворотки, это делают с особыми предосторожностями. Сначала вводят под кожу разведенную сыворотку в дозах 0,5-2,0-5,0 мл с интервалами 15-20 минут. Если реакция отсутствует, то вводят неразведенную сыворотку, сначала 0,1 мл, а затем через 30 минут, при отсутствии реакции, - всю остальную. Если в ответ на введение малых доз возникает реакция, рекомендуется вводить сыворотку под наркозом (гексоналовым, пентоталовым и др.).Усложнение приемов серотерапии и профилактики оправдывается стремлением предохранить организм от осложнений, связанных с повышенной чувствительностью к чужеродному белку в тех случаях, когда это не может послужить поводом к отмене введения сыворотки (дифтерия, столбняк, ботулизм, клещевой энцефалит и др.).
При появлении анафилактических реакций больному вводят адреналин, эфедрин, новокаин, хлористый кальций, глюкозу, гормональные препараты и сердечные средства в дозах, указанных в специальных наставлениях, которыми снабжается каждая коробка с сывороточными препаратами.В этом разделе необходимо остановиться на перспективах использования гамма-глобулина, выделенного из человеческой крови. До недавних пор он, применялся, гласным образом, для профилактики кори. Однако его применение для предупреждения других болезней, показало несомненную ценность. Это обусловлено содержанием в нем антител против соответствующих возбудителей (коклюша, оспы, по-видимому, эпидемического гепатита). Выпускается же гамма-глобулин без указания титра, антител, за исключением титра гриппозных антител в гамма-глобулине, полученном из крови иммунизированных гриппозной вакциной доноров. По-видимому, в ближайшее время будут указываться титры и других антител. Возможно, что расширится приготовление гамма-глобулинов из крови иммунизированных разными антигенами доноров. Таким образом человеческий гамма-глобулин перестанет быть только «коревым» и распространит свое влияние на другие области инфекционной патологии.
©2015 arhivinfo.ru Все права принадлежат авторам размещенных материалов.
arhivinfo.ru
Лечебные свойства иммуноглобулина человеческого нормального
Лучшее предупреждение недуга – его профилактика. Цена процедуры незначительна по сравнению с сохраненным здоровьем. Особенно, если заболевания трудноизлечимые. Существуют препараты для стимуляции иммунной природной защиты человеческого организма.
Одним из таких является иммуноглобулин человека нормальный. Данная инструкция по применению дана строго в ознакомительных и информативных целях.
Что такое иммуноглобулин человеческий нормальный
Иммуноглобулин человека нормальный – препарат на основе естественного компонента человеческого организма, взятого из фракций донорской крови. Предварительно кровь проходит множество ступеней очистки, чтобы свести наличие возможных инфекций к нулю. Потому иммуноглобулин человеческий нормальный – абсолютно безопасное и полезное средство медицины для человека.
Различные отзывы пациентов подтверждают его эффективность. Даже при беременности (в редких случаях) иммуноглобулин человека нормальный используют для введения в организм женщины. При беременности используют адаптированный иммуноглобулин антирезус. Применим антирезус в нескольких случаях.
Активные компоненты
Главным действующим веществом является иммуноглобулин человека нормальный белкового происхождения. В очень малом количестве в составе вода для инъекции и натрия хлорид. Иммуноглобулин хорошо известен как противостолбнячный препарат для внутримышечного введения. Также приобрел и другие ассоциации — иммуноглобулин человека против клещевого энцефалита, кори, проблем с иммунной системой.
Но нельзя принимать его в роли лекарства или вакцины. Препарат предназначен на укрепление иммунитета в борьбе с болезнями или с целью выработать стойкий барьер против них. К примеру, противостолбнячный барьер. Иммуноглобулин человека против клещевого энцефалита — особо ценный препарат в весенне-осеннее время.
Форма выпуска
В продаже есть иммуноглобулин человека нормальный для внутривенного введения жидкий, а также иммуноглобулин внутримышечного введения. Цена препарата доступна, как и возможность приобретения иммуноглобулина человека. Тем не менее, в отечественной медицине используют только иммуноглобулин для внутримышечного введения.
Иммуноглобулин человека нормальный для внутривенного введения жидкий используется только в виде капельницы. Купить иммуноглобулин человеческий нормальный для внутримышечного введения можно в аптеке по рецепту врача. Расфасовка препарата в ампулах по 1,5 и 3 мл.
Дозировка и курс применения внутримышечного медикамента
Человеческий иммуноглобулин нормальный не имеет ограниченных инструкций к применению. Рассчитывается доза на основе массы тела, а количество инъекций – от тяжести состояния пациента. К примеру, противостолбнячный укол ребенку не должен превышать объем 25 мл за 1 раз. Или если иммуноглобин человека против клещевого энцефалита делают взрослому, то его доза не выше 50 мл. Отношение такой дозировки к уколу при любых типах нездоровья.
Показания к применению
Использование иммуноглобулина нормального человеческого для внутримышечного введения, как гласит инструкция, возможно при ряде заболеваний:
- болезни иммунитета, иммунодефициты;
- постоперационные периоды;
- профилактика гриппозных заболеваний, кори, коклюша, менингококков, полиомиелита, также оказывает противостолбнячный эффект;
- иммуноглобулин человека против клещевого энцефалита также применяют;
- различные инфекционные заболевания, в том числе сепсис;
- заболевания крови;
- синдром приобретенного иммунодефицита – спид, чаще детский;
- другие.
Иммуноглобулин для человека нормальный для внутримышечного введения ставят в ягодичную мышцу. Место введения – верхний боковой квадрат ягодицы. Также местом для введения используют в переднюю наружную часть бедра.
Применение иммуноглобулина при беременности и в период лактации
При беременности применять иммуноглобулин человеческий нормальный нужно в строго обоснованных случаях. Исследований на реакцию организмов при беременности женщин не проводилось. Потому убеждать об отсутствие последствий на разных сроках беременности невозможно.
В период кормления ребенка грудью тоже стоит лечиться в ограниченном режиме. Любые медицинские вмешательства при беременности или лактации лучше сводить к нулю. Все же известно, что при беременности иммуноглобулин передается ребенку.
Иммуноглобулин антирезус при беременности
Когда у матери резус отрицательный, а у ребенка — положительный, то может возникнуть серьезный конфликт. Цена которого порой очень дорога: выкидыш, к примеру. Иммуноглобулин антирезус при беременности, абортах, вынужденном прерывании беременности.

Препарат иммуноглобин антирезус полезен для профилактики при первой беременности, когда резусы матери и ребенка разные. Цена такой процедуры доступна молодым мамам.
Противопоказания
Иммуноглобулин антирезус противопоказан лицам с гиперчувствительностью. Иммуноглобулин противостолбнячный человеческий для внутримышечного введения не оставляет побочных влияний. Исследования показали, что патогенных реакций не бывает. Негативные отзывы и жалобы после введения внутримышечного препарата не были получены.
На данный момент негативных воздействий препарата с другими лекарствами для внутримышечного введения на организм человека обнаружены не были.
Заключение
Цена человеческого здоровья неизмерима. Потому следите за своим самочувствием, делайте профилактические прививания, даже если вы далеко не в детском возрасте. Цена таких приемов невелика. Пользуйтесь натуральными медикаментами, что не вредят здоровью химическим составом. Отзывы свидетельствуют о безопасности данного препарата. Будьте здоровы!
vseprivivki.com
Глобулин денатурация тепловая - Справочник химика 21
Денатурация при повышении температуры. Это—наиболее обычный случай. Он более изучен, чем другие способы денатурации. Тепловая денатурация наиболее характерна для двух групп белков — альбуминов и глобулинов. Температура, при которой происходит денатурация, для различных белков различна. Для многих из их она лежит в пределах 55— 60°, для некоторых белков — выше. Указанная температура зависит также от присутствия в белковой системе электролитов и неэлектролитов. Из электролитов главное влияние оказывают анионы, которые по своему действию располагаются в лиотропный ряд. Прибавление к белковому раствору сахарозы в значительной степени предохраняет их от денатурации. [c.376] Студни альбуминов и глобулинов, подобные желатиновым, возникают только после денатурации в резко кислой или в резко щелочной среде. Под влиянием этих денатурирующих факторов внутренние связи, цементирующие глобулу, разрушаются, свернутая в глобулу молекула под влиянием теплового движения развертывается, при этом оголяются гидрофобные боковые цепи. Именно этими гидрофобными цепями молекулы взаимодействуют друг с другом, связываясь в более или менее прочную сетку студня, как это схематически показано на рис. 91. [c.300]На основании результатов исследования тепловой денатурации 7-глобулина по изменению удельного оптического вращения и оптической плотности при разных температурах [161] были определены изменения энтальпии конформационных переходов (АЯ). Полученные величины АН показывают, что связывание углеводородов белками приводит к увеличению теплоты денатурации или, что то же самое, к повышению устойчивости нативной глобулярной конформации белка по отношению к денатурации теплом. При этом связывание 7-глобулином гептана увеличивает теплоту денатурации на 10 ккал/моль (от 55 до 65 ккал1молъ), связывание декана и тетрадекана — от 55 до 57 ккал1моль. Этот факт очень хорошо объясняется особенностями заполнения глобул белка этими углеводородами, что будет рассмотрено ниже. Спектрофотометрическое исследование тепловой денатурации 7-глобулина также показало повышение устойчивости молекулы белка в ре- [c.31]
С физико-химической стороны оба белковые вещества — и альбумин и глобулин — являются ясно выраженными эмульсоидами, в растворе они удерживаются не только силой заряда, но и водной оболочкой. Поэтому после выделения казеина из молока в молочной сыворртке продолжают оставаться и альбумин и глобулин. Между собою они отличаются температурой тепловой денатурации, которая у альбумина ниже, нежели у глобулина, и наступает при 72°. Коагуляцией альбумина нагреванием сыворотки можно отделить его от глобулина, который останется в сыворотке. [c.69]
Сравнение данных по измерению удельного оптического вращения и дисперсии оптического вращения глобулярных белков в водных растворах и растворах, насыщенных углеводородом, позволило сделать вывод, что солюбилизированный углеводород практически не изменяет содержания спиральных структур в глобулах белков. Влияние солюбилизации углеводорода на устойчивость глобулярных белков к тепловой денатурации изучалось на примере яичного альбумина при pH 7,2, химотрипсина при pH 4,25 и 7-глобулина при pH 9,2 — по изменению удельного оптического вращения. Тепловая денатурация у-глобулина при pH 9,2 оценивалась также спектрофотометрически, а тепловая денатурация трипсина при pH 3,75 — по снижению ферментативной активности. [c.30]
Природа углеводородов заметно влияет па повышение устойчивости белков к тепловой денатурации [161]. Особенно ярко это проявилось при исследовании тепловой денатурации 7-глобулина, отличительной чертой которого является наличие резкого плавления вторичной структуры при повышении температуры [162]. Температура конформационного перехода 7-глобулина в водном растворе при pH 9,2 равна 63°, в присутствии гептана 67°, декана и тетрадекана 66° С. Таким образом, в результате насыщения глобулы белка углеводородом температура денатурации повышается на 3—4 . [c.31]
chem21.info
ГЛОБУЛИНЫ — Большая Медицинская Энциклопедия
ГЛОБУЛИНЫ (лат. globulus шарик) — групповое название природных белков, составляющих почти половину сывороточных белков крови человека; растворимы в слабых солевых растворах, не растворимы в дистиллированной воде и выпадают в осадок при 50% и более насыщении растворов сернокислым аммонием.
Понятие «глобулины», так же как и понятие "альбумины", возникло как результат первых попыток разобраться в сложном белковом составе животных и растительных организмов. С развитием методов выделения и фракционирования белков термин «глобулины» чаще всего стал обозначать ряд белковых фракций сыворотки крови человека и животных. Г. входят в состав любых тканей растений и животных. В организме животных и человека они обнаруживаются в сыворотке крови, молоке, слюне, цереброспинальной жидкости, в экстрактах различных органов и тканей. К Г. относятся простые белки (см.), гликопротеиды (см.), липопротеиды (см.), металлопротеиды (см.). Среди них обнаружены белки, осуществляющие транспорт липоидов , (алипопротеиды, бета-липопротеиды), гормонов (транскортин, ретинол- и тироксин-связывающие белки, альфа2-макроглобулин), железа (трансферрин, гемопексин, гаптоглобин), меди (церулоплазмин). Во фракции Г. обнаруживается активность некоторых ферментов, напр, сывороточной холинэстеразы, церулоплазмина, и некоторых ингибиторов ферментов, напр, ингибиторов трипсина, химотрипсина, тромбина, ацетилхолинэстеразы. К Г. принадлежат и некоторые факторы свертывания крови (протромбин, плазминоген, фибриноген, фибринстабилизирующий фактор). Особенно важно подчеркнуть, что к Г. относятся антитела (см.) и комплемент (см.), создающие гуморальный иммунитет. Наиболее полно охарактеризованы Г. плазмы крови. Концентрация Г. в плазме крови человека составляет 2—3%. Сывороточные Г. вместе с альбумином и низкомолекулярными веществами сыворотки крови выполняют важнейшую биол, функцию, участвуя в поддержании постоянного осмотического давление крови. Эта функция Г. становится особенно существенной при снижении содержания в сыворотке крови альбумина (в результате некоторых заболеваний, при длительной иммунизации). Определение абсолютного и относительного содержания сывороточных Г. и их фракции является дополнительным диагностическим тестом при большом числе заболеваний человека, Г. растений образуют значительную группу белков в экстрактах листьев, семян, плодов и т. п. К растительным Г. относятся взаимодействующие с углеводами лектины (см.), к к-рым принадлежит фитогемагглютинин, получивший известность как иммунологический реактив. Изучение состава соевых бобов показало, что их запасные белки, имеющие большую питательную ценность, относятся к классу Г. С конца 19 в. глобулины стали подразделять на эу- и псевдоглобулины. Эуглобулины (эвглобулины) растворимы только в слабых солевых р-рах, а при диализе против дист, воды или при 33% насыщении р-ра сернокислым аммонием они выпадают в осадок. Псевдоглобулины растворимы в воде и осаждаются при 50% насыщении р-ра сернокислым аммонием. Если классифицировать белки по электрофоретической подвижности, то к Г. относятся все белки, движущиеся медленнее, альбуминов в поле постоянного электрического тока при pH 8,2—8,6.
Изоэлектрическая точка Г. находится при pH ~7,3. Г. устойчивы в диапазоне значений pH 5,0—9,5; выдерживают нагревание при 50° в течение нескольких часов, особенно в присутствии сахара, напр, лактозы, или аминокислот, напр, глицина.
При анализе сывороточных белков методом зонального электрофореза (см.) при pH 8,6 глобулины разделяются на несколько фракций, называемых (в порядке уменьшения их электрофоретической подвижности) альфа1, альфа2, бета1, бета2 и гамма-глобулинами. Эти фракции также гетерогенны и могут содержать как эу-, так и псевдоглобулины. У человека количество белка во фракции альфа1-глобулинов составляет 4,6% всего белка сыворотки крови, альфа2-глобулинов — 7,2%, бета1-глобулинов — 12,1%, бета2-глобулинов — 5,1%, гамма-глобулинов — 11,0%. Из глобулиновой фракции плазмы крови человека выделено в гомогенном или высокоочищенном состоянии более 40 индивидуальных белков; многие их физ.-хим. свойства изучены. Кроме того, во фракции Г. обнаружен еще ряд биологически активных белков. Период полураспада смеси р- и 7-глобулинов сыворотки крови составляет 9—12 сут., а одних гамма-глобулинов 18—19 сут.
Выделение Г. проводят чаще всего осаждением сернокислым аммонием, сернокислым натрием или магнием и фосфорнокислым аммонием; фракционированием сывороточных Г. спиртом по методу Кона; электрофоретическими, хроматографическими и другими методами. Основным промышленным способом получения фракций Г. является метод Кона.
Количественное изменение электрофоретических фракций Г. (не иммуноглобулинов) и отдельных белков,, входящих в эти фракции, учитывается в клин, практике в качестве дополнительных диагностических тестов при многих заболеваниях.
Появление в сыворотке крови взрослого человека эмбрионального белка a-фетопротеина (АФП) в малых количествах (0,05—0,5% от его концентрации в сыворотке крови плода) может наблюдаться у больных вирусным гепатитом. Более значительное повышение концентрации АФП обнаруживается при гепатоцеллюлярном раке, герминогенных тератобластомах, в 10—15% случаев метастазов в печень опухолей желудка и кишечника, при наследственной тирозинемии, атаксии, телеангиэктазии. АФП используется как специфический маркер гепатомы, а динамика изменений его концентрации в крови свидетельствует о росте или регрессии опухоли.
Увеличение содержания альфа-фракции гликопротеидов в сыворотке крови наблюдается при туберкулезе, активной фазе ревматизма, экссудативных плевритах, пневмониях, гломерулонефритах, при некрозах, опухолях, сахарном диабете, в некоторых случаях макроглобулинемия
Повышение содержания в сыворотке крови a-липопротеидов (ЛП) наблюдается иногда при хрон, гепатитах, а его уменьшение — при острых гепатитах, циррозах печени, застойных желтухах. Содержание бета-ЛП в сыворотке крови увеличено при сахарном диабете, гипотиреозе, инфекционном мононуклеозе, болезни Хенда — Шюллера — Крисчена, ксантоматозе, выраженных гипопротеинемиях, в некоторых случаях миеломной болезни. Увеличение содержания альфа2-ЛП наблюдается при липоидных нефрозах у детей. Фракция липидов, выявляемая в зоне гамма-глобулинов (липидный остаток), увеличена при алиментарной и эссенциальной гиперлипемия Встречаются случаи врожденной абеталипопротеинемии и анальфалипопротеинемии. При болезни Вильсона (гепатолентикулярная дегенерация) наблюдается значительное снижение содержания церулоплазмина; менее выражено оно при нефротических синдромах и анемиях грудных детей.
Эритропоэтины, (см.), относящиеся к группе Г., принимают участие в физиол, регуляции гемопоэза, воздействуя на стволовые клетки и обеспечивая дифференцировку в клетки эритроидного ряда. Содержание эритропоэтина (Э) увеличивается при гипоксических состояниях, при гипо- или апластических анемиях в стадии обострения, в стадии прогрессирования острого лейкоза. При эритремии содержание Э в плазме крови повышается не у всех больных; при вторичных эритроцитозах это повышение наблюдается всегда. При болезни Аддисона—Бирмера и агастральной анемии Э в плазме крови вообще не обнаруживается. При острой почечной недостаточности отмечающаяся анемия объясняется нарушением образования Э (основным местом синтеза Э являются почки) и накоплением в крови ингибиторов эритропоэза.
Сывороточная комплементарная система (с. к. с.), состоящая более чем из 9 белков (первые девять обозначают от С1 до С9), участвует в иммунных процессах. Классические признаки воспаления обусловлены локальной активацией с. к. с. Врожденная аномалия ингибитора белка C1, приводящая к активации соответствующего белка, способствует возникновению ангионевротических отеков с локализацией на коже и в гортани. Повышенная чувствительность к инфекциям отмечена у лиц со сниженным содержанием С3- и C5-белков с. к. с. при отсутствии уменьшения концентрации иммуноглобулинов и нормальной гиперчувствительности замедлен* ного типа (см. Аллергия). Приобретенные дефекты C3-белка наблюдаются при пролиферативном и постстрептококковом гломерулонефритах. Снижение содержания всех компонентов комплемента может наблюдаться при системной красной волчанке. В некоторых случаях агаммаглобулинемии отмечено ингибирование белка С1. Приобретенные дефекты с. к. с. не вызывают повышенной чувствительности к инфекциям.
Снижение концентрации гаптоглобулина (ГГ) и гемопексина (ГП) в сыворотке крови наблюдается при гемолитических состояниях. При серповидно-клеточной анемии и большой талассемии концентрация C3-и C5-белков снижена. У больных с пароксизмальной ночной гемоглобинурией и аутоиммунной гемолитической анемией содержание ГП не изменено, а содержание ГГ значительно снижено. Содержание ГГ и ГП уменьшено у больных с острыми и хрон, заболеваниями печени и при нефротических синдромах. Увеличенное содержание ГП в сыворотке крови обнаруживается при злокачественных новообразованиях, сахарном диабете, активном туберкулезе, ревматоидном артрите, идиопатическом гемохроматозе, шизофрении. Определение концентрации ГП в амниотической жидкости используется для диагностики гемолитического синдрома у плода.
Общая железосвязывающая способность сыворотки (о. ж. с. с.) зависит от концентрации трансферрина (сидерофилина). Снижение о. ж. с. с. наблюдается при нефротических синдромах, острых и хрон, инфекциях, уремии. Описаны случаи врожденной асидерофилии. Повышение о. ж. с. с. может наблюдаться при железодефицитных и гемолитических анемиях.
Повышение концентрации лизоцима (см.), относящегося к Г., в сыворотке крови характерно для острых и хрон, моноцитарных лейкозов. При лейкемоидных моноцитарных реакциях лизоцимемии не наблюдается. Длительная лизоцимурия оказывает неблагоприятное воздействие на почки, вплоть до нарушения их функции.
Генетически обусловленная недостаточность факторов свертывания крови (см. Свертывающая система крови) ведет к развитию геморрагического синдрома при врожденной наследственной гипопротромбинемии, афибриногенемии, фибриногенопении. Недостаточность протромбина наблюдается при гиповитаминозах (недостаточность функции печени) и у новорожденных (мелена новорожденных, врожденная атрезия желчных путей). Увеличение содержания плазмина встречается при нефротическом синдроме, заболеваниях печени, сахарном диабете. Фибриногенопения может наблюдаться при болезнях печени, гиперфибринолизе. Недостаточность фактора XIII системы свертывания крови может быть врожденной и наблюдается при острых лейкозах.
См. также Альбумины, Белки, Иммуноглобулины.
Библиография Белки, под ред. Г. Нейрата и К. Бэйли, пер. с англ., т. 3, ч. 1, М., 1958; Введение в клиническую биохимию, под ред. И. И. Иванова, Л., 1969; Гликопроте-ины, под ред. А. Готтшалка, пер. с англ., т. 2, ч. 4, с. 58, М., 1969; SchultzeH. E. a. Heremans J.F. Molecular biology of human proteins, Amsterdam, 1966; T u r-ner M. W. a. H u 1 m e B. The plasma proteins, an introduction, L., 1971; Werner М., Brooks S. H. a. Cohnen G. Diagnostic effectiveness of electrophoresis and specific protein assays evaluated of discriminate analysis, Clin. Chem., v. 18, p. 116, 1972.
И. Д. Гроздова, А. К. Голенков.
xn--90aw5c.xn--c1avg
Глобулин Глобулин, выделение - Справочник химика 21
Протеины, содержащиеся в сырой крови, фракционировались [293] двумя растворителями смесью диэтиленгликоля и этилового эфира, а также водным раствором сульфата магния. Этим же методом выделен чистый у-глобулин из лошадиной сыворотки. [c.421]Препаративные ультрацентрифуги предназначены для выделения из растворов отдельных фракций. Конечно, эти фракции могут быть однородны только по одному показателю — по скорости седиментации, а по другим свойствам могут значительно отличаться. Например, гамма-глобулины человека (один из видов белков крови, широко известный в медицине как лечебное средство) при центрифугировании обычно разделяется на две фракции с константами седиментации 75 и 19S. Белки, образующие эти фракции, заметно различаются между собой и по ряду других свойств (иммунологическим свойствам, электрофоретической подвижности и т. п.). [c.148]
Для выделения у-глобулинов из сыворотки кролика обычно используют метод трехкратного высаливания сульфатом аммония при конечном насыщении 33%. Соли затем удаляют диализом. [c.308]МЕТОДЫ ВЫДЕЛЕНИЯ И ОЧИСТКИ ФРАКЦИИ АЛЬБУМИНОВ И ГЛОБУЛИНОВ [c.152]
Выделение альбуминов и глобулинов из семян. [c.44]
Извлечение глютелинов. Остаток муки после-выделения глобулинов обрабатывают, как и в предыдущих случаях, 0,2% раствором едкого натра и после отстаивания фильтруют. К 10 каплям щелочной вытяжки добавляют по-каплям 0,2% раствор уксусной кислоты. Появляется осадок глютелинов в виде мути. [c.286]
Эти данные показывают, что отдельные глобулины, выделенные из семян бобовых, резко различаются по многим свойствам. Альбумины и глютелины бобовых, содержащиеся в меньщем количестве в семенах, изучены еще недостаточно. [c.388]
При гепато-лентикулярной дегенерации (болезнь Вильсона) наблюдается генерализованная аминоацидурия, связанная с поражением печени [87—89]. Однако аминоацидурия может появиться до развития признаков заболевания печени существенное повышение уровня аминокислот в крови обычно отсутствует. Имеются также указания на экскрецию пептидов с мочой при этом заболевании [89]. Особый интерес представляют данные о том, что у таких больных нарушен обмен меди [90—95]. Наблюдается отложение меди в чечевицеобразном ядре мозга, печени и роговице с мочой выделяются необычно большие количества меди в виде клешневидных комплексов с пептидами дикарбоновых аминокислот. В нормальной сыворотке крови медь связана с одним из а-глобулинов, церулоплазмином. Концентрация этого белка снижена при болезни Вильсона, однако общее количество меди в сыворотке крови соответствует норме или превышает ее [93, 95]. Между экскрецией аминокислот и экскрецией меди имеется параллелизм — например, повышенное выделение аминокислот, вызванное пищевым рационом с высоким содержанием белка, сопровождается повышенной экскрецией [c.469]
Белки обладают не только видовой, но также и органной специфичностью. Так, например, белки сыворотки отличаются серо-логически от гемоглобина или от мышечных белков того же самого животного. Впрочем, некоторые фракции глобулинов, выделенные дробным осаждением сернокислым аммонием, очень сходны между собой, и при помонш реакции преципитации их удается различить лишь с большим трудом [7]. Ферритин (см. гл. XI) видоспецифичен, но не обладает органной специфичностью [8]. [c.330]
Сходное строение с орозомукоидом имеет а-глобулин, выделенный из плазмы крови теленка, — фетуин. Его молекулярная масса 45 ООО— 49 700. Некоторые детали строения фетуина выяснены в результате ферментативного и частичного кислотного гидролиза. Под действием мейраминидазы или 0,25 н. серной кислоты (80 °С 1 ч) отщепляются сиаловые кислоты. При более жестком кислотном гидролизе гликопеп-тида, полученного деструкцией фетуина протеолитическими ферментами, выделен дисахарид [c.92]
Измерения с помощью ультрацентрифуги, произведенные Гейдельбергом, Педерсеном и Тизелжусом, послужили доказательством того, что антитела являются видоизмененными сывороточными белками. С тщательно очищенными препаратами были получены константы седиментации, подобные константам, определенным для сывороточного глобулина кроме того, иммунная активность оказалась связанной с тем веществом, константа седиментации которого измерялась. В сочетании с электрофоретическими измерениями оказалось возможным разделить глобулины с одинаковым молекулярным весом, но с различными электрохимическими свойствами. Оказалось, что фракция -глобулина, выделенная из сыворотки кролика, несет функции антител [84]. Пневмококковые антитела человека также связаны с фракцией -глобулина и по форме молекул значительно отличаются от сферической формы [85]. Зайберт, Педерсен и Тизелиус [86] показали, что полисахариды и белковые фракции, выделенные из различных фильтратов туберкулезных бацилл, имеют одинаковые константы седиментации (около 1,7 10" ). Они по существу однородны и имеют молекулярный вес около 9000. Для белков туберкулезных штаммов быка и человека было найдено, что молекулярные веса равны соответственно 10 000 и 32 000. [c.547]
Растворы высокомолекулярных веществ в термодинамически равновесном состоянии аналогично истинным растворам обладают абсолютной агрегативной устойчивостью, что определяется наличием на повср.хности частиц двух оболочек электрической и сольватной (гидратной). Для коагуляции коллоидов высокомолекулярных соединений необходимо не только нейтрализовать заряд коллоидной часгицы, но и разрушить жидкостную оболочку. Выделение высокомолекулярных соединений цз растворов по своему характеру отличается от коагуляции типичных гидрофобных коллоидов. Так, если для гидрофобных золей достаточно незначительных добавок электролита, чтобы вызвать коагуляцию, то для высокомолекулярных веществ этого недостаточно. Для выделения дисперсной фазы полимеров необходимы высокие (вплоть до насыщенных растворов) концентрации электролитов. Например, яичный глобулин выделяется при полунасыщении раствора сульфатом аммония, а яичный альбумин — только при полном насыщении. [c.381]
В 20-40-е гг. получили развитие физ.-хим. методы анализа Б. Седиментациоиными и диффузионными методами были определены мол. массы многих Б., получены данные о сферич. форме молекул глобулярных Б. (Т. Сведберг, 1926), выполнены первые рентгеноструктурные анализы аминокислот и пептидов (Дж. Д. Бернал, 1931), разработаны хроматографич. методы анализа (А. Мартин, Р. Синг, 1944). Существенно расширились представления о функциональной роли Б. был выделен первый белковый гормон-инсулин (Ф. Бантинг, Ч. Г. Бест, i922 антитела были идентифицированы как фракция у-глобулинов (1939) и тем самым обнаружена новая ф-ция Б.-защитная. Важным этапом явилось открытие ферментативной ф-ции мышечного миозина (В.А. Энгельгардт, М. Н. Любимова, 1939) и получение первьк кристаллич. ферментов (уреазы-Дж. Б. Самнер, 1926 пепсина-Дж.X. Нортроп, 1929 лизоцима-Э. П. Абрахам, Р. Робинсон, 1937). [c.248]
Высаливание. При добавлении растворов солей щелочных и щелочноземельных металлов происходит осаждение белков из раствора. Обычно белок не теряет способности растворяться вновь в воде после удаления солей методами диализа или гельхроматографии. Высаливанием белков обычно пользуются в клинической практике при анализе белков сыворотки крови и других биологических жидкостей, а также в препаративной энзимологии для предварительного осаждения и удаления балластных белков или выделения исследуемого фермента. Различные белки высаливаются из растворов при разных концентрациях нейтральных растворов сульфата аммония. Поэтому метод нашел широкое применение в клинике для разделения глобулинов (выпадают в осадок при 50% насыщении) и альбуминов (выпадают при 100% насыщении). [c.26]
С физико-химической стороны оба белковые вещества — и альбумин и глобулин — являются ясно выраженными эмульсоидами, в растворе они удерживаются не только силой заряда, но и водной оболочкой. Поэтому после выделения казеина из молока в молочной сыворртке продолжают оставаться и альбумин и глобулин. Между собою они отличаются температурой тепловой денатурации, которая у альбумина ниже, нежели у глобулина, и наступает при 72°. Коагуляцией альбумина нагреванием сыворотки можно отделить его от глобулина, который останется в сыворотке. [c.69]
Наиболее богаты белковыми веществами семена масличных и бобовых растений. В некоторых из них содержание белков достигает 40%.. Эти белковые вещества относят с глобулинам за их способность растворяться в 8 — 10%-ном растворе поваренной соли. По химиче-скому составу, определенному путем гидролиза и выделения образовавшихся в результате гидролиза аминокислот, они весьма различны между собой, как это видио из табл. 9 (по данным Вальдшмидт-Лейтца). [c.108]
Из продуктов переработки крови в СССР в настоящее время для пластических масс употребляется черный кровяной альбумин, высушенный распылением. Для его изготовления кровь освобождается от фибрина, сепарируется для отделения светлого и темного альбумина и остаток, состоящий из альбумина, глобулина, гемоглобина и остаточного, не выделенного при дефибрировании фибрина, рафинируется и сушится распылением. Остаточная влага в черном альбумине должна быть доведена до S /o. В противном случае альбумин досушивается на пуговичной фабрике. [c.197]
Как и в предыдущих разделах, мы попытаемся кратко рассмотреть применение ионообменной хроматографии на примере изучения белков сыворотки. До сих пор наиболее популярным методом разделения сывороточных белков является хроматография на колонке анионообменной ДЭАЭ-целлюлозы по методу Собера и Петерсона [18]. Предложено несколько модификаций этого метода. Фракции сыворотки элюируются с колонки различными способами градиентного элюирования и выходят обычно в следующем порядке IgG (как правило, имеет несколько пиков), р-, а-глобулины и затем альбумин. Этот метод особенно эффективен для приготовления препаратов IgQ высокой иммунохимической чистоты из нативной сыворотки. Его можно комбинировать с другими способами очистки, например с осаждением риванолом, Na2S04 и т. п. Подобным образом в качестве одного из этапов препаративного выделения анионообменная хроматография может применяться для очистки других белков сыворотки. При изучении структуры белка ее можно использовать для выделения и очистки полипептидов после расщепления белка ферментами или какими-либо другими веществами. [c.23]
Для разрушения пептидной части гликопротеинов широко применяется протеолиз, особенно часто под действием проназы (обычно из 81гер1от св5 г15тч), которая является набором мощных протеиназ, способных разрушать пептидные цепи, устойчивые к другим протеолитиче-ским ферментам. Часто употребляются также трипсин, химотрипсин, па-паин. Гидролизат, полученный после обработки протеиназами, подвергают фракционированию с применением диализа, гель-фильтрации и хроматографии (см., например, ), выделяя один или несколько низкомолекулярных гликопептидов, структуру которых устанавливают обычными методами и иногда подтверждают встречным синтезом. Впервые гидролиз гликопротеина трипсином был применен Нейбергером для выделения фрагмента овальбумина, содержащего узел связи олигосахаридной и пептидной части молекулы в дальнейшем для этой же цели использовали также химотрипсин, пепсин и другие фepмeнты " . . Протеолиз проназой очень широко применялся при выделении узловых фрагментов из 7-глобулина , тиреоглобулина фибриногена и особенно му- [c.571]
Методика опыта (кристаллизация альбумина). Источником получения альбумина обычно служит белок куриного яйца. В 10 свежих куриных яйцах тщательно отделяют белок от желтка и к выделенному белку добавляют равный объем насыщенного (ЫН4)2304. Выпадает осадок глобулина, который отделяют в центрифуге при 2500 об/мин. Центрифугат осторожно сливают на складчатый фильтр или в воронку Бюхнера и отсасывают его. При температуре 20° С отмеряют определенный объем фильтрата и добавляют к нему тонко измельченный (Nh5)2S04 из расчета 8,5 г (ЫН4)2504 на 100 мл фильтрата. При этом выпадает желтовато-розовый осадок альбумина, который отфильтровывают на воронке Бюхнера или через складчатый фильтр. Отфильтрованный осадок альбумина растворяют (стакан погружают в ледяную воду) в возможно меньшем количестве воды. В раствор добавляют по каплям (при помешивании) 5%-ный раствор СН3С6ОН до pH = 4,7 (проверяют ионометром). Раствор отфильтровывают, чтобы исчезла муть. К фильтрату добавляют большими порциями насыщенный раствор (Nh5)2S04 (при встряхивании) до появления так называемой муаровой мути. При температуре от О до 2° С через 1—2 суток образуются игольчатые кристаллы альбумина. Кристаллический альбумин следует хранить в растворе с 2—3 каплями толуола, который применяют в качестве антисептика. [c.43]
Глобулины растений также гетерогенны и состоят из двух фракций с константами седиментации 11S и 7S. Одним из представителей llS-глобулиновявляется глицинии. Этот белок, выделенный из сои, имеет молекулярную массу порядка 300—400 kDa и характеризуется повышенным содержанием аргинина, аспарагина и глютамина. Он состоит из 12 субъединиц, каждая из которых содержит 6 различных полипептидных цепей. [c.48]
В последние годы белки растительного происхождения все в большей степени используют для питания не только животных, но и человека. Прямое потребление человеком растительных белков касается в первую очередь зерно-вьгх культур, бобовых, а также различных других овощей. Выделение высоко-очищенных белков (изолятов) происходит в несколько стадий. На первой стадии белки избирательно переводятся в растворимое состояние. Эффективность разделения твердой (примеси) и жидкой (белки) фаз является залогом получения в дальнейшем высокоочищенного продукта. В большинстве случаев белки из растительных источников являются альбуминами или глобулинами, причем глобулины растворимы в слабых солевых растворах, а альбумины — еще и в чистой воде. Белковый экстракт содержит много сопутствующих растворимых продуктов, поэтому на второй стадии белки отделяют осаждением или, используя различия в размерах или в электрическом заряде, применяют мембранную технологию, а также другие приемы (электродиализ, ионообменные смолы, молекулярные сита и др.). Когда оптимальные условия растворимости белков определены, выбор конкретного технологического процесса зависит от вида сырья и целевого продукта. [c.58]
Эритроциты предварительно фиксируют формалином или глютараль-дегидом, а затем связывают их с гамма-глобулином, который выделяют из иммунных сывороток и очищают от других сывороточных белков. Связывание гамма-глобулина с поверхностью эритроцитов производят с помощью хлорида хрома. Для этого к 8 объемам дистиллированной воды добавляют 1 объем иммуноглобулинов, выделенных из иммунной сыворотки, 1 объем 50%-й взвеси формалинизированных эритроцитов и 1 объем 0,1 — 0,2%-го раствора хлорида хрома. Смесь оставляют на 10 — 15 мин при комнатной температуре, затем обрабатывают эритроциты, как при РНГА. [c.64]
Высаливание белков концентрированными растворами ЫагЗО или (Nh5)2S04 применяется при выделении ферментов из экстрактов тканей и является одним из методов фракционирования белковых смесей на альбумины и глобулины. Растворимость белков уменьшается также при добавлении дегидратирующих веществ (спирта, ацетона). [c.114]
Было установлено, что при действии ультразвуковых волн на белки, выделенные из сыворотки крови, уменьшается их вязкость и возрастает содержание 5Н-групп. Этот процесс при длительной обработке становится обратимым [92]. С другой стороны, существуют указания на то, что в этих условиях происходит расщепление комплексов лннопротеидной или танни1шротеино-вой природы с изменением количественного отношения между четырьмя составными частями глобулина ( ь кг, Р и у) в сторону увеличения фракций Г1 и аг. [c.246]
Даже через 6—12 мес. после интратрахеального введения пыли К. в легкие крысам или кроликам в них обнаруживаются лишь пылевые скопления, бедные клеточными элементами, с минимальным развитием волокнистой соединительной ткани некоторое утолщение межальвеолярных перегородок, а также явления бронхита (Архангельская Величковский и др.). Отмечаются незначительные дистрофические изменения в паренхиматозных органах, небольшая гнперглобулинемкя, но без характерного для реакции на оксид К. повышенного содержания гамма-глобулинов. Эти изменения можно связать с резорбтнв-ным действием кремниевой кислоты, о котором свидетельствует ее повышенное выделение с мочой крыс после введения К- в легкие. Действие пыли К. на человека не описано. При электротермической выплавки К-, как и при выплавке различных кремнистых ферросплавов, опасность развития силикоза связана с загрязнением рабочей зоны аэрозолем конденсации Si02 (см. Оксид кремния), который образуется через оксид К.(П). [c.356]
Пептиды из нитрованного лизоцима, содержащие остатки нитротирозина, выделяли на сефарозе (Sepharose) с иммобилизованными антителами [45] (рис. 34.16). Антитела получали иммунизацией кроликов и коз комплексом нитротирозин—белок. Антитела выделяли из сыворотки методом аффинной хроматографии на сефарозе с фиксированным нитро-у-глобулином [46]. После десорбции 0,1 М уксусной кислотой антитела конденсировали с сефарозой, получая, таким образом, иммуносорбент. Последний использовали для выделения в одну стадию пептидов с остатком нитротирозина. [c.415]
Комплексы сывороточных белков с другими веществами белковой природы могут быть также выделены с помощью гель-хроматографии, как это было уже показано на примере комплекса гемоглобин — гаптоглобин (фиг. 16) [49]. Еще проще количественно определить емкость гемоглобина (способность гемоглобина к комплексообразованию) на сефадексе G-100 [50]. Фракция макроглобулинов (выделение на сефадексе G-200), очевидно, содержит белок, связывающий трипсин [51, 52]. Активность при этом сохраняется лишь частично [51, 52]. Комплексы антиген — антитело часто выделяли на пористых гелях, а затем после разложения на составные части исследовали более подробно (см. литературу, приложение IX). В предыдущем разделе на примере инсулина были рассмотрены возможности изучения растворимых иммунокомплексов. Иммунологические методы в сочетании с гель-фильтрацией играют важную роль в исследовании строения Y-глобулинов. Среди работ на эту тему (см. литературу, приложение X) имеются блестящие исследования, посвященные восстановительному расщеплению и выделению L- и Н-цепей, их рекомбинации, ограниченному действию папаина и, наконец, иммунологическим свойствам интактного белка и его фрагментов. [c.218]
Извлечение глобулинов. Остаток муки после выделения альбуминов обрабатывают в ступке 3 мл 10% раствора хлористого натрия и после отстаивания фильтруют. С фильтратом, содержащим глобулин, проделывают биурето-вую реакцию и реакцию высаливания (см. стр. 9 и 37). [c.286]
Ход работы,. I. Получение казеина. Дать люлоку отстояться и тщательно снять верхний слой (жир). Снятое молоко разбавить двумя объемами воды и затем при помешивании по каплям осторожно добавить 0,1—0,5%-ную уксусную кислоту до прекращения выделения осадка белка (следует избегать значительного избытка уксусной кисдоты). Осадок казеина отсосать, промыть два-три раза водой и затем спиртом, отжать на воронке под вакуумом и высушить на воздухе. В кислом фильтрате (молочная сыворотка). находятся молочный глобулин и альбумин. Их осадить насыщением фильтрата сернокислым аммонием или кипячением раствора после подкисления. [c.180]
В настоящее время общепринято, что ферменты являются белками. Финский биохимик А. И. Виртанен выдвинул обратное положение, что белки представляют собой ферменты. Если это второе положение нужно рассматривать как преувеличение, то первое справедливо без исключений, хотя, правда, каталитической активностью могут обладать и фрагменты белковой молекулы. Первое доказательство белковой природы ферментов было получено в 1926 г., когда фермент уреазу выделили в виде чистого кристаллического препарата и установили, что этот фермент является белком глобулином. Эти результаты американского ученого Самнера противоречили взглядам выдающегося немецкого химика Рихарда Вилльштеттера. Вилльштеттеру в некотором отношении не повезло, так как он работал с ферментом пероксидазой, обладающей чрезвычайно высокой каталитической активностью. В процессе очистки были получены активные препараты пероксидазы, не содержащие заметных количеств азота, а в ряде случаев в них не удавалось обнаружить ни углерода, ни азота. После выделения кристаллической уреазы Вилльштеттер считал, что полученный белок был лишь неспецифическим носителем лабильной и каталитически [c.9]
Между альбуминами и глобулинами существует постепенный переход, образующий почти непрерывный спектр растворимости, а так как растворимость и тех и других увеличивается с повышением концентрации соли, эти две группы белков нельзя резко разграничить. Ряд глобулинов, встречающихся в некоторых семенах в качестве запасных белков, выделен в кристаллической форме, например эдестин из конопляного семени, эксцельсин из бразильского ореха, арахин и конарахин из земляного ореха. Альбумины, вероятно, не являются запасными белками, и не все глобулины относятся к этой группе. Так, например, р-амилаза, содержащаяся в семенах ячменя, представляет собой альбумин, а а-амилаза — глобулин. Основные запасные белки хлебных злаков это проламины и глютелины. [c.10]
Кроме этих белков, в молоке были найдены и некоторые другие белки. К ним следует причислить опализин, выделенный из сыворотки женского молока высаливанием хлористым натрием. Имеются также указания на присутствие в молоке белка, похожего на проламин. Однако эти белки (кроме казеиногена, альбумина и глобулина) находятся в молоке в весьма незначительных количествах и в настоящее время мало изучены. [c.319]
chem21.info
Гамма-глобулины
10
Просты́е белки́—белки, которые построены из остатковα-аминокислоти при гидролизе распадаются только на аминокислоты.
Простые белки по растворимости в воде и солевых растворах условно подразделяются на несколько групп: протамины,гистоны,альбумины,глобулины,проламины,глютелины.
Альбумины и глобулины широко распространены в органах и тканях животных. В плазме крови человека в норме содержится 7% белков, представленных преимущественно альбуминами и глобулинами. Альбумины и глобулины – глобулярные белки, различающиеся по растворимости.
Необходимо отметить, что само определение «альбумины» и «глобулины» основано на их растворимостивдистиллированной водеи полунасыщенномрастворе(Nh5)2SO4. Однако, как показывают данные табл. 1.6,глобулинырастворимы только в разбавленных солевыхрастворах.
Различную растворимостьальбуминовиглобулиновсыворотки кровираньше широко использовали в клинической практике для их фракционирования и количественного определения.
В настоящее время качественный состав и содержание сывороточных белковопределяют с помощьюэлектрофорезанабумагеи в полиакрил-амидномгелев небольшом количествесыворотки крови.Альбуминыиглобулиныотличаются друг от друга также помолекулярной массе– соответственно 40000–70000 и 150000 и более.
Глобулины(globulinum; лат. globulus, уменьшительное от globus шар)
— общее название белков, растворимых в слабых растворах нейтральных солей, кислот и щелочей, как правило, нерастворимых в дистиллированной воде и выпадающих в осадок при 50% насыщении растворов сульфатом аммония; глобулины составляют около 40% всех белков сыворотки крови человека.
Гамма-глобулин - любойбелокБЕЛОК (protein) - органическое соединение, в состав которого входят углерод, водород, кислород и азот (..., присутствующий в плазме крови, который можно идентифицировать по характерной скорости его движения в электрическомполеПОЛЕ - 1) в социологии - изучаемая среда, аудитория, которую опрашивают в ходе полевых исследований (в...Фракция γ-глобулинов является наиболее гетерогенной. Известно множествоантител, различающихся первичной структурой. Электрофоретически они открываются главным образом в γ-глобулиновой и частично в β2-глобулиновой фракциях.
К неоднородной группе гамма-глобулинов относятся белки с самой низкой электрофоретической подвижностью. К ним относится большинство защитных веществ крови, многие из которых обладают ферментативной активностью. Так как потребности в белках, выполняющих такие специальные функции, бывают различны, размеры и состав фракции гамма-глобулинов может значительно изменяться. Почти при всехзаболеваниях, особенно воспалительных, содержание гамма-глобулинов в плазме крови повышается. В то же время общее количество белков в плазме обычно остается примерно одинаковым, так как повышение содержания гамма-глобулинов сопровождается уменьшением фракцииальбумина, в результате снижается так называемый альбумин-глобулиновый коэффициент. Почти всегаммаглобулиныГАММАГЛОБУЛИН (gamma globulin) - любой белок, присутствующий в плазме крови, который можно идентифицировать по ...являются иммуноглобулинами
Иммуноглобулины.
История открытия.
Иммуноглобулины представляют собой белки человека (животных), которые обычно обладают свойствами антител, т.е. специфической способностью соединяться сантигеном, который стимулирует их образование. Иммуноглобулины присутствуют в крови, цереброспинальной жидкости, лимфоузлах, селезенке, слюне и других тканях, а так же в видерецепторовна поверхностныхмембранахклеток. Синтезируются они в В-лимфоцитах, содержат углеводные группировки и могут рассматриваться как гликопротеины. По электрофоретической подвижности иммуноглобулины относятся в основном к гамма-глобулинам и бета2-глобулинам. Биологическая роль иммуноглобулинов в организме связана с участием в процессах иммунитета. Их защитная функция обусловлена способностью специфически взаимодействовать с антигенами.До середины 50-х годов прошлого столетия о структурной организации иммуноглобулинов ничего не знали. Первый шаг в этом направлении сделал английский иммунохимик Р.Портер в 1959 г. Он показал, что при обработке очищенных иммуноглобулинов протеолитическими ферментами образуются три фрагмента, два из которых взаимодействуют с антигеном (патогеном) и потому названы антигенсвязывающими (Fab), и один, неспособный к такому взаимодействию (Fc).
Но это ничего не говорило о причинах их специфичности по отношению к разным антигенам. Для получения информации о молекулярных основах вариабельности нужно было значительное количество полностью идентичных белков. Сывороточные иммуноглобулины, в массе образующиеся после иммунизации, не давали такой возможности, поскольку они - производные нескольких клеточных клонов, каждый из которых продуцирует белки только одного класса и только одной, свойственной ему, специфичности. Иначе говоря, иммуноглобулины, выделяемые от иммунизированных животных, есть смесь молекул с разной специфичностью и разной принадлежностью к тому или иному классу.
Необходима была экспериментальная модель, позволяющая работать с одним клоном, образующим иммуноглобулины только одной специфичности и только одного класса. Природа предоставила такую возможность - злокачественно трансформированные плазматические клетки больных миеломой. В настоящее время существует большой набор клонированных плазмоцитов человека и животных, продуцирующих соответствующие миеломные белки.
Строение.(см. пример: строение IgG)
Изучение аминокислотной последовательности иммуноглобулинов выявило принципиальные особенности в их строении.
Молекулы иммуноглобулинов симметричны. Они построены из "легких" (около 220 аминокислотных остатков, молекулярная масса 25000 для IgG) и "тяжелых" (450-600 аминокислотных остатков, молекулярная масса для IgG- 50000) полипептидных цепей (соотв. L- (light) и Н-цепи (heavy)),скрепленныхдисульфидными связямии нековалентными взаимодействиями. Вантителахчеловека обнаружено два вида легких цепей ( и ) и пять видов тяжелых цепей( и ), отличающихсяаминокислотной последовательностью. Тяжелые цепи, характерные для каждого из классов и подклассов иммуноглобулинов, содержат по одному или более олигосахаридному фрагменту (степень гликозилированности отражается на биологических свойствах иммуноглобулинов).
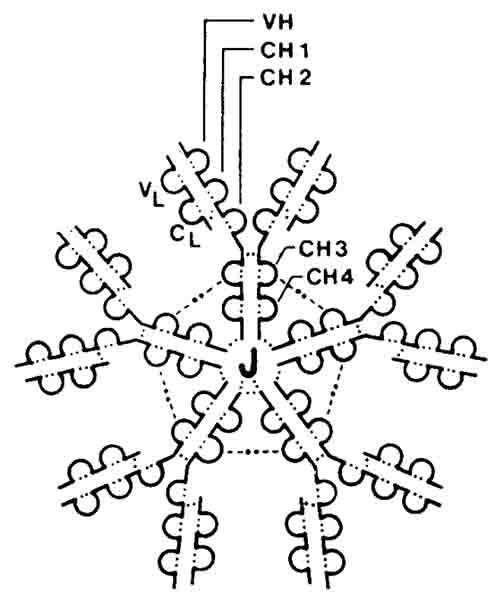
Р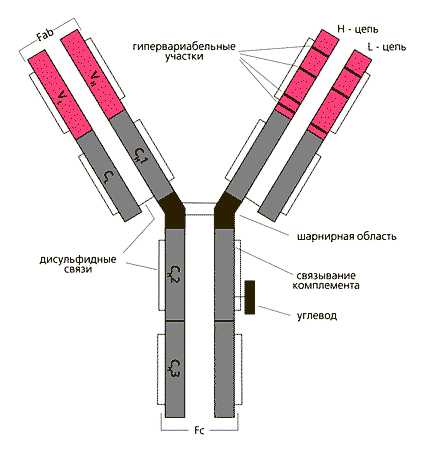 ис.1.Строение иммуноглобулина G.
ис.1.Строение иммуноглобулина G.
Две тяжелые (Н) цепи с мол. весом 50 кД и две легкие (L) с мол. весом 25 кД объединены в единую молекулу с помощью ковалентных дисульфидных связей. Каждая цепь содержит вариабельную область (VL и VH для L- и H-цепей соответственно) и константную (С), подразделяющуюся у Н-цепей на гомологичные участки (домены): Ch2, Ch3, CН3. L-цепь имеет один константный участок - CL. От взаимодействия VH- и VL-областей зависит специфичность иммуноглобулинов как антител. В аминокислотной последовательности V-доменов имеются гипервариабельные участки, характеризующиеся частой заменой аминокислот от белка к белку, и более консервативные. Между СН1 и СН2 доменами Н-цепи находится шарнирная область, обеспечивающая подвижность антигенсвязывающего Fab-фрагмента. СН2-домен служит местом присоединения углеводов и связывания комплемента. СН3-домен взаимодействует с Fc-рецептором (не способным связывать антиген) на поверхности клеток, принимающих участие в иммунологических реакциях.
Лёгкие цепи различных видов отличаются друг от друга С - концевой последовательностью аминокислот. С - концевая половина полипептидной цепи имеет постоянную аминокислотную последовательность, а ее N - концевая часть - вариабельную. Каждый постоянный (Сl) и вариабельный (Vl) участок легкой цепи включает 107-110 аминокислотных остатков. Тяжелые цепи построены их четырех участков - VH, C1H, C2H, C3H. Вариабельные участки их состоят приблизительно из 110-114 аминокислотных остатков, постоянные - 330.
В вариабельной части полипептидных цепей находятся определенные, так называемые "гипервариабельные участки", с наибольшим числом аминокислотных замен. В легких цепях они расположены между 24-34; 52-55; 89-97 аминокислотными остатками. Гипервариабельные участки тяжелых цепей занимают аналогичные положения, но точная локализация их пока не установлена.
Строение постоянных областей тяжелых цепей определяет эффекторные функции молекул к поверхностям макрофагов, В-лимфоцитов, тучных клеток, а также проникновение через плацентарную мембрану.
Гибкость молекул иммуноглобулинов, обеспечивающая приспособляемость к различным конфигурациям молекул антигена, обусловливается также наличием особого "шарнирного участка" в середине тяжелых цепей, содержащего много остатков аминокислоты пролина и препятствующего образованию вторичной структуры. Шарнирная область чувствительна к протеолитическим ферментам. При расщеплении ими (например, папаином) иммуноглобулин распадается на два идентичных Fab-фрагмента и один Fc-фрагмент.
В настоящее время на основании изучения первичной структуры полипептидных цепей выдвинута так называемая "доменная" гипотеза строения иммуноглобулинов, согласно которой молекулу иммуноглобулинов можно разбить на участки с относительно независимыми конфигурациями в виде глобул. Каждый домен состоит приблизительно из 100-110 аминокислотных остатков и имеет одну дисудьфидную связь, которая связывает участки цепей, образуя петлю из 60 аминокислотных остатков.
Молекулыиммуноглобулинов связанные с поверхностьюлимфоцитов, имеют дополнительные гидрофобные "хвосты" на С-концах тяжелых цепей, которые встроены вмембраныклеток. Пептидные цепи иммуноглобулинов и рядабелковклеточных мембран(антигеныгистосовместимости,рецепторыдляантигеновТ-лимфоцитов) по своей первичной структуре сходны между собой, что указывает на общее эволюционное происхождение всех этихбелков.
Связывание с антигенами.
На N-концах тяжелых и легких цепей расположены те самые вариабильные области, которые в сочетании и образуют антигенсвязывающую структуру - паратоп в составе Fab-фрагмента. Три или четыре домена со стороны С-концов тяжелых цепей составляют константную часть молекулы - Fc-фрагмент (не связывают антиген). Fc-Фрагмент состоит из четырех или шести доменовдвух тяжелых цепей и определяет такие свойства иммуноглобулинов, как связывание имикомплемента, возможность проникать черезплаценту, присоединяться кклетками фиксироваться вкоже. Поскольку в состав молекулы иммуноглобулина входят две легкие и две тяжелые цепи, они формируют два паратопа (области, контактирующие с антигеном) в составе двух Fab-фрагментов, т.е. антитело бивалентно: может соединиться с двумя идентичными антигенными эпитопами. Этому способствует наличие шарнирной области между первым и вторым доменами константного фрагмента тяжелых цепей, благодаря которой обеспечивается возможность пространственной ориентации Fab-фрагментов для связывания с антигенными эпитопами. Комплекс с антигеном образуется в результате нековалентных взаимодействий, характер которых может варьировать в зависимости от специфичности антитела- связи могут быть ионными, вандерваальсовыми, водородными, при помощи солевых мостиков и гидрофобных взаимодействий.. Сила связывания с антигеном увеличивается на несколько порядков, если молекула антитела реагирует сразу двумя (или более) областями связывания с несколькими детерминантами одной молекулы антигена.
Каждая индивидуальная клетка вырабатывает антитела только одной
специфичности по правилу "одна клетка " одно антитело" (Петров , 1987). Это
означает, что в клетке активно функционируют только один вариант гена VH,
один - гена СH и по одному соответствующему гену одной из легких цепей. Все
остальные структурные гены выключены. В каждой отдельно взятой антитело-
образующей клетке из всего множества структурных генов иммуноглобулинов
функционирует их минимальное количество, необходимое для синтеза антител
одной специфичности и одного типа. Таким образом, в основе многообразия
специфичности антител лежит функционирование в лимфоидной системе большого
количества клеток и их потомков - клонов клеток - продуцентов одного вида
антител. Следовательно, количество специфичностей антител соответствует
количеству клонов клеток-антителопродуцентов, различающихся генами,
функционирующими в них.
Генетика.
Особенностью этих полипептидных цепей является отсутствие единого гена, кодирующего структуру всей полипептидной цепи. Всякий раз сборка такого гена происходит из отдельных сегментов. Этим обеспечивается бесконечное разнообразие структур молекул антител, способных распознать любую существующую в природе структуру антигена. Иными словами, набор (репертуар) специфических участков связывания в популяции иммуноглобулинов организма столь широк, что на любой попадающий в организм антигенный эпитоп (участок связывания) обязательно найдется строго комплементарный паратоп в составе антиген-связывающего фрагмента (Fab - фрагмента) какого-то иммуноглобулина. Поэтому говорят, что легкие и тяжелые пептидные цепи каждого класса иммуноглобулинов построены из двух основных областей - вариабельной и постоянной.
Все их антигенные детерминанты кодируются тремя несцепленными группами аутосомных генов. Одна группа кодирует тяжелую цепь
того или иного класса, другая - легкуюk-типа, третья – легкую-типа.Так как полипептидные цепи состоят из двух различных участков - вариабельного (V) и постоянного (С), каждая из трех групп генов включает набор генов вариабельной - V и постоянной областей -С-гены. Таким образом, синтез каждой полипептидной цепи молекулы иммуноглобулина контролируется двумя структурными генами, а не одним, как при синтезе других белков. Один ген кодирует вариабельную область цепи, другой- постоянную. Причем существуют многие гены для вариабельных
областей полипептидной цепи, что связано с многообразием специфических
активных центров.
Классификация.
Семейство иммуноглобулинов у высших позвоночных включает в себя несколько классов;
| © п/п | Показатели | IgM | IgG | IgA | IgE | IgD |
| 1. | Молекулярная масса | 900т. | 150т. | 170т. и 300т. | 190т. | 180т. |
| 2. | Уровень в крови в г/л | 0,5 - 1,8 | 6 -16 | 1 - 5 | 0,00002 | 0,03 - 0,04 |
| 3. | Тип тяжелых цепей | m 1 - m 2 | g 1 - g 4 | a 1 - a 2 | e | s |
| 4. | Формула | 5 H5L | 2h3L | 4h5L | 2h3L | 2h3L |
| 5. | Фиксация С | ++++ | ++ | + S | - | - |
| 6. | Нейтрализация токсинов | + | + | + | - | - |
| 7. | Агглютинация | + | + | + | - | - |
| 8. | Бактериолиз | + | + | ? | - | - |
| 9. | Прохождение плаценты | - | + | - | - | - |
у человека их известно пять (G, М, A, D, Е). Классы иммуноглобулинов делятся на подклассы. Все классы иммуноглобулинов отличаются друг от
друга количественным содержанием углеводного компонента. Наиболее богаты
углеводами иммуноглобулины М, А, Е и Д (7,5 - 12,0%). В молекулах IgG
содержится около 2,9% углеводов. В составе иммуноглобулинов обнаружены
манноза, галактоза, галактозамин, глюкозамин, фукоза и сиаловая кислота.
У молекул IgG, IgD, IgE и IgA (молекула IgA построена подобно молекуле IgG) 2 активных центра, у молекул IgM - 10.
рис2: схемы строения различных иммуноглобулинов.
Иммуноглобулины класса G.
IgG представляет собой наиболее изученное антитело, в большом количестве присутствующее в сыворотках крови всех млекопитающих и птиц. IgG составляет около 70-80% от общего содержания иммуноглобулинов. Молекулярная масса - 150 000 - 160 000 (Незлин, 1972).
Молекула иммуноглобулина G- построена из двух тяжелых и двух легких
полипептидных цепей, соединенных дисульфидными связями. Характерны
тяжелые а следовательно, и антигенными и биологическими свойствами полипептидные цепи. IgG человека существует в виде 4 подклассов
(G1, G2, G3, G4), отличающихся строением постоянных участков тяжелых цепей, а следовательно, и антигенными и биологическими свойствами.
Подклассы различаются
количеством дисульфидных связей, соединяющих тяжелые цепи: в молекулах G1 и
G4 их по 2, в G2, - 4, а в G3, -5. IgG1 составляет 70% от общего содержания
IgG, а IgG2, IgG3, IgG1 18, 8 и 3%, соответственно.
У всех изученных видов животных найдены два подкласса IgG: относительно
медленно передвигающиеся в электрическом поле G2 и более подвижные G1. Их
молекулы имеют различные антигенные и биологические свойства, а также способность к перевариванию протеолитическими ферментами. Расшифрована первичная структура обеих цепей иммуноглобулина G1(Edelman, 1973). Тяжелые цепи его состоят из одной вариабельной области - VH и 3 постоянных участков - Сн1, Сн2 и Сн3. Длину вариабельных областей составляют 114, а постоянных - 330 аминокислотных остатков, легкие из областей V1, СL.
С помощью электронной микроскопии (Valentine, Jreen, 1967), выяснено,
что молекула иммуноглобулина G имеет V-образную форму, при этом Fab
фрагменты образуют "лапки" молекулы , а Fc- фрагмент - ее "хвост". Она
имеет два активных центра, находящихся в вариабельной части молекулы, а
именно на кончиках Fab фрагментов.
У человека только IgG способен проникать через плаценту и попадать в
кровеносную систему плода, обеспечивая тем самым пассивный иммунитет
новорожденных в ранний постнатальный период.
Влияние на организм:
Повышение:
- аутоиммунные заболевания (системная красная волчанка, ревматоидный артрит, синдром Шегрена), саркоидоз
- паразитарные болезни
- хронические инфекции
- внутриматочные контрацептивы
Снижение:
- иммунодефицит
- иммуносупрессивная терапия
Иммуноглобулины класса А.
Рис. 3. Строение иммуноглобулина А (димер).
IgA циркулирует в сыворотке в виде мономеров или димеров.
Мономер с молекулярной массой 160 кДа. Существует также димерная форма IgA. Характерен для секретов организма (слюна, слезы, пот, молозиво, пищеварительный сок, выделения слизистых поверхностей). В сыворотке крови его содержание незначительно и составляет 10-15% от общего количества сывороточных иммуноглобулинов. Тем не менее, считается, что среди иммуноглобулинов всех классов IgA синтезируется в наибольших количествах (больше, чем IgG). В сутки у человека продуцируется до 3 г IgA.
Тяжелая α-цепь построена из вариабельного домена, трех константных доменов и шарнирного участка. У человека известны два подкласса — IgAl и IgA2. Сывороточный IgA обычно представлен мономером.
Димер IgA может связываться с поли-иммуноглобулиновым рецептором на базо-латеральной поверхности эпителиальных клеток и в комплексе с этим рецептором проникать в эпителиальные клетки. Внутри эпителиальной клетки такой комплекс подвергается протеолизу и через апикальную поверхность эпителиальной клетки секретируется образовавшийся комплекс димера IgA с фрагментом полиглобулинового рецептора, который получил название «секреторный компонент». Таким образом в состав секретов слизистых попадает секреторный IgA SIgA, который обеспечивает местный иммунитет слизистых, препятствуя процессам адгезии и адсорбции возбудителей (бактерий и вирусов) на чувствительных клетках. Уровень продукции IgA значительно выше, чем у других классов иммуноглобулинов, так как у него короткий полупериод жизни и значительная часть его секретируется в виде SIgA.
IgA в сыворотке крови человека содержится в относительно большем
количестве, чем IgМ и составляет около 19% от общего количества
иммуноглобулинов (Hobby, 1971). В сыворотке крови многих видов
животных, в частности овец и крупного рогатого скота, IgM преобладает над
IgA. Значительное количество этого белка обнаружено в лимфе, где
концентрация его в 2-18 раз выше, чем в крови (Стефани, 1971). Антитела
найдены и в содержимом кишечника и фекалиях, 80% которых приходится на
долю IgА.
Секреторный IgA обладает выраженной бактерицидностью, антивирусными и антитоксическими свойствами, активирует комплемент, стимулирует фагоцитоз, играет решающую роль в реализации резистентности к инфекции.
Влияние на организм:
Повышение:
- хронические заболевания печени
- хронические инфекции, особенно ЖКТ и дыхательных путей
- ревматоидный артрит и другие ревматические заболевания
Снижение:
- иммунодефицит
Иммуноглобулины класса М.
IgМ - один из высокомолекулярных белков
сыворотки крови и имеет молекулярную массу около 1 млн, константу
седиментации 19 Se. Молекула IgМ состоит из 5 субъединиц, каждая из которых
напоминает молекулу IgG (рис. 2). Субъединица состоит из двух тяжелых и
двух легких цепей с молекулярными массами 23 000 и 60 000 соответственно, (-
цепь состоит из 5 доменов VH, С1(- С4(, легкая - изVL, и СL. Молекула 1IgM
имеет 10 активных центров, расположенных в Fab областях ( Прокопенко, Равич-
Щербо, 1974, Литмен , Гуд, 1981).
Рис. 4. Схема строения молекулы IgМ
IgМ содержит около 10% углеводов., функция которых обусловлена с
образованием макромолекулы IgM из 7 S субъединиц к формированием
пространственной структуры молекулы (Каверзнева, 1984). IgМ по рваному
реагирует на восстановление 2- меркаптоэтанолом: при мягком он распадается
на 5-7 S субъединиц, а при более глубоком на тяжелые и легкие полипептидные
цепи.
Важнейшее свойство молекулы IgМ, необходимое для ее функционирования - конформационная подвижность при изменении условий внешней среды. При электрофорезе IgМ передвигается быстрее иммуноглобулинов класса G во фракции (2- глобулинов. Найдено 2 подкласса IgМ, с различными антигенными свойствами (Гауровец, 1969, Бернет, 1971, Незлин , 1972, Кульберг , 1975).
Сывороточная концентрация IgM составляет 0,5-2 мг/мл (~5 % от общего количества сывороточных иммуноглобулинов). На мембране В-лимфоцитов присутствует мономерная форма IgM, выполняющая функцию основной составляющей В-клеточного рецептора. IgM- антитело первичного иммунного ответа, так как синтезируется первым после антигенной стимуляции. Через несколько дней синтез IgМ переключается на IgG, а позже -на IgА.
IgM синтезируется раньше других классов в онтогенезе, может продуцироваться в организме плода в ответ на внутриутробную инфекцию.
IgM в основном имеет внутрисосудистую локализацию, небольшое количество его обнаружено в тканевых жидкостях, но в слизистых выделениях он обычно отсутствует (Jonas, 1972). У большинства же животных (кроме кроликов) IgM через плаценту проходить не может ( Маслянко , 1973).
Является маркерм остроты процесса. После появления более поздних антител – IgG, его количество падает.
К этому классу иммуноглобулинов относятся изогемагглютинины групп крови: антиА, анти-В
Влияние на организм:
Повышение:
- вирусная инфекция
- ранний период бактериальной или паразитарной инфекции
- ревматоидный артрит, саркоидоз и др
Снижение:
- иммунодефицит
- потеря белка (патология ЖКТ, ожоги)
Иммуноглобулины класса D.
IgD изучен недостаточно. Впервые он охарактеризован как четвертый класс иммуноглобулинов D.Rowe, G.Fahey(1965). Его молекулярная масса около 180000. Молекула IgD состоит из двух легких и двух тяжелых полипептидных цепей, связанных дисульфидными мостиками. Мономер. Тяжелая цепь IgD построена из одного вариабельного и трех константных доменов. Содержится в сыворотке в исчезающих количествах. Функция сывороточного IgD неизвестна. На поверхности В-лимфоцитов присутствует мембранная форма IgD, входящая в состав В-клеточного рецептора.
Содержание в сыворотке не превышает 1% от общего количества иммуноглобулинов. Они не проходят через плаценту и относятся к коротко-живущим.
Вопрос о форме участия IgD в иммунных процессах оставался недостаточно ясным вплоть до 2000 г. Тем не менее, показано, что в сыворотке ею концентрация повышается с возрастом: достигая максимума к 10 годам, а в 15-летнем возрасте соответствует концентрации, отмечаемой у взрослого человека. Содержание увеличивается у больных бронхиальной астмой, ревматическими заболеваниями, болезнью Ходжкина, иммунодефицитными синдромами, хронической лимфатической лейкемией, системной красной волчанкой. Понижен процент при лимфомах. Кроме того, IgD обнаружены как антитела к пенициллину, инсулину, тиреоидину, белкам молока и дифтерийному токсину
Иммуноглобулины класса Е.
IgE впервые идентифицирован K. Ishisaka, Молекулярная масса IgЕ 190 000, константы седиментации8 S. Молекула IgE также состоит из двух легких и двух тяжелых
полипептидных цепей, молекулярная масса которых 22 600 и 72 500 соответственно. Содержание углеводов свыше 12%.
studfiles.net
Глобулин (globulin) — с русского
См. также в других словарях:
Глобулин (Globulin) — представитель группы простых белков, который хорошо растворяется в разбавленных солевых растворах и свертывается под действием тепла. В крови присутствуют различные глобулины (сывороточные глобулины (serum globulins)), в том числе альфа, бета и… … Медицинские термины
ГЛОБУЛИН — (globulin) представитель группы простых белков, который хорошо растворяется в разбавленных солевых растворах и свертывается под действием тепла. В крови присутствуют различные глобулины (сывороточные глобулины (serum globulins)), в том числе… … Толковый словарь по медицине
антигемофильный глобулин — АГГ или антигемофильный фактор VIII.; фактор белка в сыворотке крови, который способствует "каскаду" химических реакций (вовлекающий 17 компонентов крови) и который приводит к формированию сгустка в ране… … Справочник технического переводчика
гамма-глобулин — Тип белков крови, участвующих в иммунном ответе [http://www.dunwoodypress.com/148/PDF/Biotech Eng Rus.pdf] Тематики биотехнологии EN gamma globulin … Справочник технического переводчика
Гаммаглобулин (Gamma Globulin) — любой белок, присутствующий в плазме крови, который можно идентифицировать по характерной скорости его движения в электрическом поле (см. Электрофорез). Почти все гаммаглобулины являются иммуноглобулинами. Инъекция гаммаглобулина обеспечивает… … Медицинские термины
СЫВОРОТКА АНТИЛИМФОЦИТАРНАЯ, ГЛОБУЛИН АНТИЛИМФОЦИТАРНЫЙ — (antilymphocyte globulin, ALG) иммунная сыворотка, в состав которой входят антитела, подавляющие лимфоцитарную активность; изготавливается из лимфоцитов животных. Антилимфоцитарная сыворотка может вводиться больному для предотвращения иммунной… … Толковый словарь по медицине
Сыворотка Антилимфоцитарная (Antilymphocyte Serum, Als), Глобулин Антилимфоцитарный (Antilymphocyte Globulin, Alg) — иммунная сыворотка, в состав которой входят антитела, подавляющие лимфоцитарную активность; изготавливается из лимфоцитов животных. Антилимфоцитарная сыворотка может вводиться больному для предотвращения иммунной реакции, вызывающей отторжение… … Медицинские термины
глобюлин — globulin m. Глобулин. Когда процеженная жидкость <кровь> будет выкипячена, тогда гематозин, глобюлин и белковина свертываются. ОЗ 1852 5 8 205 … Исторический словарь галлицизмов русского языка
ГАММАГЛОБУЛИН — (gamma globulin) любой белок, присутствующий в плазме крови, который можно идентифицировать по характерной скорости его движения в электрическом поле (см. Электрофорез). Почти все гаммаглобулины являются иммуноглобулинами. Инъекция гаммаглобулина … Толковый словарь по медицине
TBG — abbr. med. thyroxine binding globulin – тироксинсвязывающий глобулин … Dictionary of English abbreviation
Агаммаглобулинемия — (agammaglobulinaemia, от греч. a нет + gamma globulin гамма глобулин фракция белка плазмы крови + haima кровь) – состояние организма, при котором отсутствуют или резко снижено содержание гамма глобулинов в крови, когда ор ганизм более… … Словарь терминов по физиологии сельскохозяйственных животных
translate.academic.ru